如图所示接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
(1)U形管内可观察到_____________,写出有关反应的化学方程式:_______________。
(2)在小烧杯a、b中分别有什么现象产生?_______________________________________。
(3)如果小烧杯中有0.508 g碘析出,问烧杯c中负极的质量减轻_____________g。
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: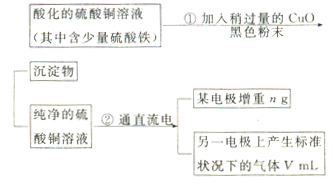
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:。电解的离子方程式为。
(4)下列实验操作中必要的是(填写字母)。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: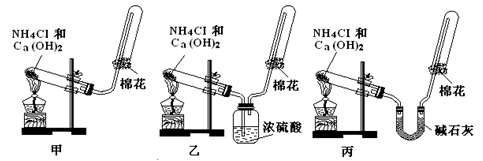
(1)三位同学制取氨气的化学方程式为:
_____________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是____________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替制备NH3?____________(填“能”或“不能”)。
(12分)实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。回答下列问题: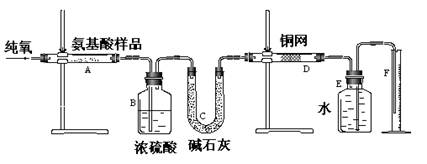
(1)实验开始时,首先通入一段时间的氧气,其理由是_;
(2)以上装置中需要加热的仪器有______(填写字母),操作时应先点燃________处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________________________。
(4)D装置的作用是。
(5)实验中测得氮气的体积为V mL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有___。
| A.生成二氧化碳气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |
.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是______,它与溴水反应的化学方程式是______________________________;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。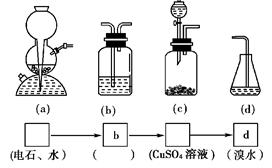
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是_________________________________________________________。
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白: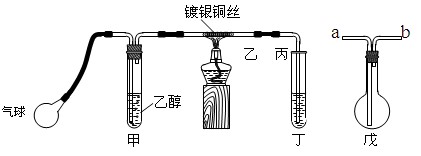
(1)甲装置常常浸在70~80℃的水浴中,目的是。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为。
②控制鼓气速度的方法是,若鼓气速度过快则会,若鼓气速度过慢则会。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在 _____中。