化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是 (填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度。
甲组方案:
试剂X从下列试剂中选择:
a.0.1mol·L-1KMnO4(H2SO4酸化)溶液b.0.5mol·L-1NaOH溶液c.新制氯水d.KI溶液
①加入的试剂X为 (填字母序号),生成SO42-主要的离子方程式为 。
②甲组方案中,第iii步的“系列操作”包含的操作名称各为 。
乙组方案:
i.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ii.精确量取20.00mL过滤后废水试样,选择使用紫色的0.1 mol·L-1KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
iii.记录数据,计算。
③乙组设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是 。
(4)用下图装置进行CO2性质的有关实验。
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是 。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________ mL。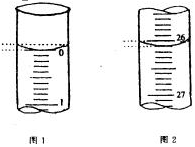
(4)某学生根据三次实验分别记录有关数据如下表: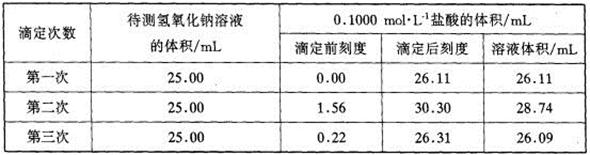 请用上述数据列式计算该氢氧化钠溶液的物质的量浓度。
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度。
下图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的装置图,请回答下列问题: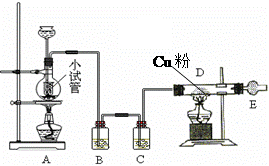
⑴ 小试管的作用是;烧瓶中发生反应的化学方程式是;
⑵ B瓶中的溶液是,其作用是;C瓶中盛放的溶液是,其作用是。
⑶ 玻璃管D中反应的现象是。
⑷ 干燥管E中盛有碱石灰,其作用是。
⑸ 开始实验时,应先点燃处(填“A”或“D” )的酒精灯,当时再点燃另一处的酒精灯。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为;漂白粉有效成分为(填名称);瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。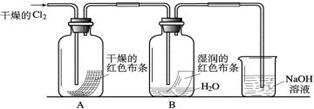
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是;其中发生的反应的化学方程式为。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是。
c.烧杯中溶液所起的作用是,烧杯中所发生反应的化学方程式为。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
mL。
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H 2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒。转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水注入容量瓶直到液面接近刻度处。改用滴加蒸馏水到瓶颈刻度的地方。振荡摇匀后,装瓶贴签。
(4)在配制过程中,其他操作都准确,下列操作中错误的是(填序号,以下同),能引起误差偏高的有。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)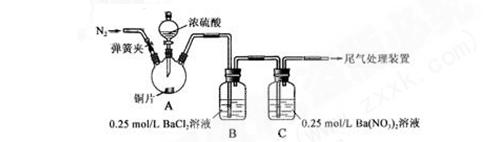
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚 未发现白色沉淀溶解 未发现白色沉淀溶解 |
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________。