(下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
(1)为了检验此盐中是否含有碘酸钾,可用KI-淀粉溶液和稀盐酸做试剂进行检测。加入KI-淀粉溶液和稀盐酸后,若盐中含有碘酸钾,则会发生如下反应:KIO3 + 5KI + 6HCl = 6KCl+3I2+3H2O,生成的I2遇淀粉变蓝。在上述反应中氧化剂与还原剂物质的量之比为 。
(2)为了测定此盐的钙元素含量,取10克此盐溶于水,加入足量盐酸,生成标准状况下67.2ml二氧化碳气体。请计算此加钙食盐 中钙元素的质量分数(取2位有效数字)。
中钙元素的质量分数(取2位有效数字)。
(本题共16分)
已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示).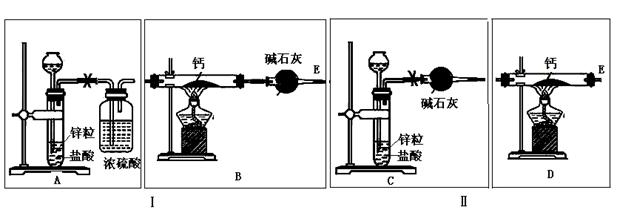
请回答下列问题
(1)锌与盐酸反应的离子方程式为;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。
装置Ⅰ的不足之处是,
装置Ⅱ的不足之处是;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示);
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先,然后再
,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为。
硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。
①试管b中得到的主要产物是,检验该产物的方法是(结合离子方程式简要说明)。
②为检验反应的另一种生成物,试管c中应加入的试剂是,简述相应的实验现象及结论。
③所得硫酸的理论浓度(溶质的质量分数)为。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是,a、b两处所含气体的化学式分别为、。
②有关接触法制硫酸的下列说法中,不正确的是。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的硫酸浓度为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率 B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:①生产成本低、②原料易得、③、④ 、⑤、⑥(可不填满)。
、⑤、⑥(可不填满)。
(16分)、据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:
已知:一定条件(Ⅰ)RNH2+ CH2Cl→ RNHCH2
CH2Cl→ RNHCH2 +HCl(R和
+HCl(R和 代表烃基);
代表烃基);
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ) (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)
(Ⅳ)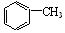 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
回答下列问题:
(1)C的结构简式是 。
(2)请写出D+E→F的化学方程式: 。
(3)E在一定条件下,可聚合成很好的功能高分子材料,写出合成此高聚物的化学方程式 。
(4)反应①~⑤中,属于取代反应的 是(填反应序号)
是(填反应序号)
(5)符合下列条件的E的同分异构体的数目是()。
①与FeCl3溶液有显色反应②能发生银镜反应③苯环上的一溴取代物只有3种。
| A.3种 | B.8种 | C.10种 | D.12种 |
(6) 已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),反应方程式如下:
C6H5CHO + (CH3CO)2O → C6H5CH="CHCOOH" +CH3COOH
苯甲醛肉桂酸
若苯甲醛的苯环上有取代基,也能发生Perkin反应,相应产物的产率如下:
反应物 |
 |
|||
| 产率(%) |
15 |
23 |
33 |
0 |
反应物 |
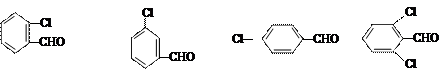 |
|||
| 产率(%) |
71 |
63 |
52 |
82 |
请根据上表回答:取代基对Perkin反应的影响有(写出3条即可):
①
②
③ [来
为了研究铜与硝酸的反应,化学兴趣小组设计了如下实验装置,其中a、b、c是活塞。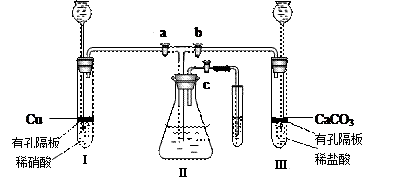
(1)装药品前,按图装置连接后,如何检验气密性?
(2)按
图装药品后,如果开启 a 和 c ,关闭b ,则Ⅱ中的现象是
;若要使Ⅱ里的气体始终保持无色,应该怎样操作?
写出Ⅰ及Ⅱ中发生的反应的离子方程式:
(3)如果将Ⅰ管中的稀硝酸换成浓硝酸,开启 a 和 c ,关闭 b ,过一会观察,可以看到Ⅱ里没入水中的导管有气泡冒出,导管内气体呈红棕色,液面上方气体为无色,试用文字及方程式解释这一现象 。
。
(4)在实验(2)中,如果装置Ⅰ、Ⅱ里液面上空间的总体积为Vml,空气中氧气的体积分数为 21%,实验在标准状况下进行,全部氧气通过反应转化为硝酸;实验开始时加入的铜为mg,实验完毕后剩余铜ng,Ⅱ中所得溶液的体积也为Vml(不考虑装置外空气的可能进入)。则Ⅱ中所得溶液的物质的量浓度是。
W、X、Y、Z是短周期中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X原子最外层电子数等于电子层数,Z元素的最高价氧化物的水化物的酸性是最强的。
(1)W位于元素周期表第______周期第______族。W的气态氢化物稳定性比 ______(填“强”或“弱”)。
______(填“强”或“弱”)。
(2)Y有两种常见的氧化物,能同时使溴水和酸性高锰酸钾溶液褪色的是(写化学式),并写出这两个离子方程式:
_______________________________________________________________________
________________________________________________________________________
(3) 实验室制取Z的单质的化学方程式是:_______________________________________。
实验室制取Z的单质的化学方程式是:_______________________________________。



X的单质和FeO反应的热化学方程式是_________________________________________。