下图是以C7H8为原料合成某聚酰胺类物质(C7H5NO)n的流程图。
已知:Ⅰ.当一取代苯进行取代反应时,新引进的取代基受原取代基的影响而取代邻、对位或间位。使新取代基进入它的邻、对位的取代基:-CH3、-NH2;使新取代基进入它的间位的取代基:-COOH、-NO2。
Ⅱ.R-CH===CH-R′R-CHO+R′-CHO
Ⅲ.-NH2易被氧化;-NO2可被Fe和HCl还原成-NH2。
(1)X、Y、Z是下列试剂中的一种,其中X是 ,Y是 ,Z是 。(填序号)
①Fe和HCl ②酸性KMnO4 ③浓硝酸、浓硫酸混合液
(2)A-F中互为同分异构体的有 。(填结构简式)
(3)步骤②③ (填“能”或“不能”)对调,理由 。
(4)写出④的反应方程式 ;
写出⑤的反应方程式 。
请认真运算,并将正确答案填写在空白处。(不得使用计算器)
(1)恒温下,向pH = 6的蒸馏水中加入2.3 g金属钠充分反应后,再加蒸馏水稀释至1L,所得溶液的pH =
(2)常温下,pH = 5的稀H2SO4溶液稀释1000倍,则稀释后溶液中 的比值为
的比值为
(3)25℃,在等体积的①pH=0的H2SO4溶液②0.05 mol/L的Ba(OH)2溶液③pH=10的K2S溶液④pH=5的NH4NO3溶液中发生电离的水的物质的量之比为
(4)当NH3·H2O和盐酸混合恰好中和成c mol/L的NH4Cl稀溶液,试用c、c(H+)及氨水的Kb值、水的Kw值表示该溶液中 的平衡浓度,c(
的平衡浓度,c( )平=
)平=
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色。(图中其它生产物未列出)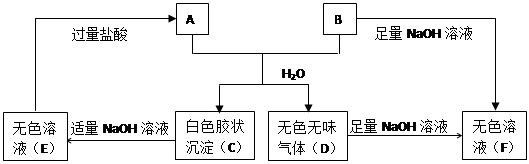
(1)无色溶液(F)中,一定含有的溶质的化学式为
(2)写出白色胶状沉淀C转化为无色溶液E的化学方程式
(3)A、E两溶液混合反应时,可观察到的现象是,写出其反应的离子方程式
(4)A和B的混合物溶于水发生反应的离子方程式
以下各题中各量的关系,请用“﹥”、“=”或“﹤”表示。
(1)pH = 3的醋酸和pH=11的氢氧化钠溶液等体积混合,混合液中c(Na+) c(CH3COO-)
(2)等物质的量浓度、等体积盐酸和醋酸钠混合,混合液中各离子浓度的大小关系为
(3)常温下,若NaOH溶液中的c(OH-)与NH4Cl溶液中的c(H+)相同。现将NaOH和NH4Cl的溶液分别稀释10倍,稀释后NaOH和NH4Cl溶液的pH分别用pH1和pH2表示。则pH1+ pH214
(4)现有pH相等、等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1 、V2 、V3的大小关系
在相同条件下进行Mg和酸反应的对应实验,相关数据如下:
| 镁的质量 |
酸量 |
开始的反应速率 |
产生H2总量 |
|
| Ⅰ |
0.24g |
HCl: 0.2 mol/L 100mL |
ν1 |
n1 |
| Ⅱ |
0.24g |
CH3COOH:0.2 mol/L 100mL |
ν2 |
n2 |
(1)试比较有关量的大小:ν1 ν2、n1 n2 (填“﹥”“=”“﹤”)
(2)现欲改变条件,使实验Ⅰ中ν1降低,但不改变n1的值,试写出两种可行的方法:
①②
根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH﹤7
(4)将饱和氯化铵溶液加入到硅酸钠溶液中很快生成白色胶状沉淀,并产生刺激性气味的气体