质检总局通报全国婴幼儿奶粉三聚氰胺含量抽检结果,伊利、蒙牛、圣元、雅士利等22个厂家69批次产品中检出三聚氰胺,并被要求立即下架。乳制品的蛋白氮的测定是质检部门的一个常见的工作。实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
 步骤I 称取样品1.500 g。
步骤I 称取样品1.500 g。
 步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
 步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
 ⑴根据步骤III填空:
⑴根据步骤III填空:
 ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
 ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
 ③滴定时边滴边摇动锥形瓶,眼睛应观察____________
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
 A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
 ④滴定达到终点时,酚酞指示剂由_________色变成_________色。
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
 ⑵滴定结果如下表所示:
⑵滴定结果如下表所示:
滴定 次数 次数 |
待测溶液的体积 /mL /mL |
标准溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下 (金属离子含量与pH、CuCl产率与混合液中pH的关系图)
(金属离子含量与pH、CuCl产率与混合液中pH的关系图)
请回答下列问题:
(1)电镀污泥的主要成分是(写化学式);
(2)酸浸时发生反应的离子方程式是;
(3)析出CuCl晶体时的最佳pH在左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是。
(1)某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
F(g) + xG(g), △H<0。若起始时E的浓度为a mol/L,F ,G浓度均为0,达平衡时E浓度为0.5a mol/L ;若E的起始浓度改为2a mol/L,F ,G浓度仍为0,当达到新平衡时:
①若X=1,容器体积保持不变,新平衡下E的体积分数为________.
②若X=2,容器体积保持不变,新平衡下F的平衡浓度____0.5a mol/L。
(2)t℃将3mol A气体和1mol B气体通入2L固定体积的密闭容器中,发生如下反应:3A(g) + B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下面空白:
①从开始反应至达到平衡状态,生成C的平均反应速率为_________,X=_____.
②若继续向原平衡混合物中通入少量氦气(不参与反应)后,化学平衡将____移动。
③若向原平衡混合物的容器中再充入a molC,在t℃达到新的平衡,此时B的物质的量为n(B)=_____________mol。
④如果上述反应在相同温度和容器中进行,欲使反应达到平衡时物质的量分数与原平衡时相同,起始加入的三种物质的物质的量n(A)n(B) n(C)之间应该满足的关系为_____________________.
根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。
(1)I元素在元素周期表中的位置;M中阴离子的结构示意图:。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为。
(3)写出下列化学反应的离子方程式:
①溶液P与KSCN溶液:________________________________________;
②G与N的反应:______________________________________ ____ ______;
______;
③K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
已知某溶液只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下关系:
①c(Cl-)> c(NH4+) > c(H+) > c(OH-)②c(NH4+) > c(OH-) > c(Cl-)>c(H+)
③c(NH4+) > c(Cl-)> c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+) > c(OH-)
填写下列空白:
⑴若溶液中只有一种溶质,则该溶质是_________________,上述四种离子浓度的大小顺序(填序号)______________。
⑵若四种离子的关系符合③,则溶质为______________;若四种离子的关系符合④,则溶质为______________
⑶将pH相同的溶液稀释相同的倍数,下面图像正确的是(填图像序号)______________。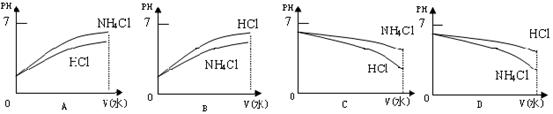
⑷若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O)(填“>”、“=”、“<”);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)_______c(OH-) (填“>”、“=”、“<”)。
已知:一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图作答: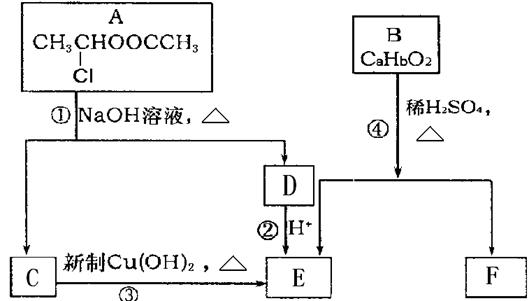
(1)A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是。
组峰;E中含有的官能团的名称是。
(2)反应③的化学方程式为。
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2)︰n(H2O)=2︰1,则B的分子式为。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:
①属于芳香族化合物;②能跟FeCl3溶液发生显色反应;
③能发生加聚反应;④苯环上的一氯代物只有两种。
F在一定条件下发生加聚反应的化学方程式为 。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有种结构,写出其中不含甲基的同分异构体的结构简式。