实验室里有一瓶KCl与CaCl2的固体混合物,通过下面实验可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl,根据实验步骤填写下列空白:
(1)调整零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右)______旋动。
(2)某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如图3-2示。
下面的操作应该是_______和______。
(3)加入的A是______,检验A是否过量的方法是______。

(4)过滤时,某学生的操作如图3-3所示,用文字说明图中的错误_____。
(5)滤液中加入的B物质是_______,应该加入过量B物质,理由是_____。
(6)为检验沉淀是否洗净,应在最后几滴洗出液中加入______,若______,表示沉淀已洗净。
(7)得到的固体C是_______。
(8)该混合物中KCl和CaCl2质量比的计算式是_____。
(9)配制100mL0.20mol·L-1的KCl溶液:某学生将准确称取的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,将溶液由烧杯转移到100mL容量瓶中,然后往容量瓶中小心地加蒸馏水,直到液面接近标线2—3cm处,改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度相切,把容量瓶盖盖好,振荡摇匀,该学生操作中错误的是_____。
【改编】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下: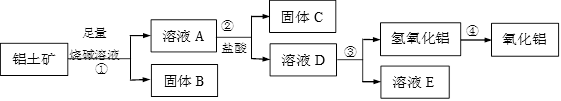
(1)第①步,向铝土矿中加入足量烧碱溶液后,Al2O3发生反应的离子方程式是_______________;固体B是_________;第②步中,涉及到的离子方程式___________________、____________________;
(2)第③步中,生成氢氧化铝最好选用下列试剂中__________试剂(填序号)
| A.二氧化碳 | B.氨气 |
| C.氢氧化钠溶液 | D.盐酸 |
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
《实验化学》甲苯氧化法制备苯甲酸的反应原理如下: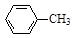 + 2KMnO4
+ 2KMnO4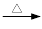
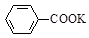 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O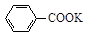 + HCl
+ HCl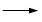
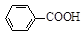 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
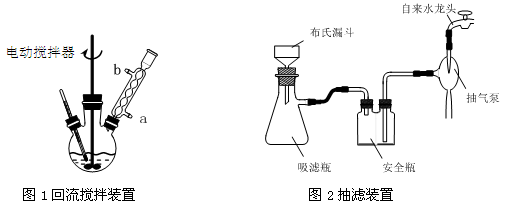
(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水一般采用氧化法,常用的氧化剂有氯气、二氧化氯、次氯酸盐双氧水等。
(1)工业上常用双氧水处理含CN-离子浓度较低的废水,流程如下: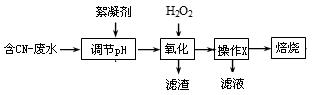
操作X的名称为 。滤液中常含有H2O2,排放前需除去,写出除去H2O2的方法
(2)实验室中可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题: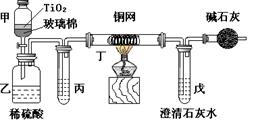
①乙中反应的离子方程式为 。丁在实验中的作用是 。
②乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 |
| C.浓NaOH溶液 | D.浓硫酸 |
③若该测得值与实际处理的百分率相比偏低,请简要说明可能的原因 。请提出一个能提高准确度的建议(具体操作) 。
④处理后的溶液,主要含有HClO、Na+、H+、Cl-等,请设计实验证明溶液中含有HClO和H+的实验方案:
【改编】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2: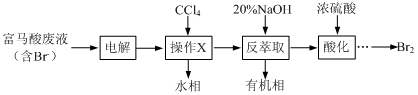
(1)操作X的名称为 ;电解后溶液的酸性 (填增强、减弱、不变)。
(2)反萃取时加入20%的NaOH溶液,其化学方程式为 。溴易挥发,故用浓硫酸酸化时需采取的操作为 ;
(3)流程中可以循环使用的物质为 (填化学式)。
(4)溴的传统生产流程为先采用氯气氧化,再用空气将Br2吹出。与传统工艺相比,萃取法的优点是 。
[实验化学]2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下: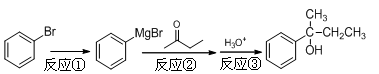
【实验装置】
【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
(1)步骤1中加入碘的作用是 。
(2)装置Ⅰ中滴加液体所用的仪器的名称是 ,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是 。
(3)步骤三中分离出油层的具体实验操作是 。
(4)装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接 ;采用这种蒸馏方式的原因是 。