现有4组离子,每组有2种金属离子。请各选用1种试剂,将它们两者分开,可供选用的试剂有:
| A.硫酸 | B.盐酸 | C.硝酸 | D.氢氧化钠溶液 E.氨水请填写下表:(填写时用字母代号) |
| 离子组 |
选用的试剂(代号) |
沉淀物的化学式 |
保留在溶液中的离子 |
| (1)Zn2+和Al3+ |
|
|
|
| (2)Zn2+和Mg2+ |
|
|
|
| (3)Zn2+和Ba2+ |
|
|
|
| (4)Fe3+和Al3+ |
|
|
|
化学实验离不开水。请根据水的不同作用和功能,分析以下四个装置图,回答问题:
实验一:制取氢气
(1)图甲所示装置可用于实验室制取氢气,这种制气装置在加入反应物前,如何检查气密性 。
(2)用锌与稀硫酸制取氢气时,加入少量硫酸铜溶液会加快产生氢气的速率,请解释加快反应速率的原因: 。
实验二:喷泉实验
(3)图乙所示装置中烧瓶已装满干燥氨气, 进行喷泉实验时应该先___________(填“挤捏胶头滴管”或“打开止水夹”)。
(4)如果只提供如图丙所示装置,若想迅速引发喷泉,下列方法可行的是 。
a.用热毛巾捂住烧瓶
b.用冰块捂住烧瓶
c.将烧杯中的水换成饱和食盐水
d.向烧杯中加入少量硫酸
实验三:探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图丁所示。
①开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝;
②再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停止实验;
③重复三次实验得平均加水量为2.5 mL(水的密度按1.0g/mL计算)。
(5)该实验装置的不足之处是__________________________。
(6)当指针第一次指向铜丝时,正极的电极反应式为 。
(7)根据此实验计算,使铁钝化的硝酸最低质量分数为 。
研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置: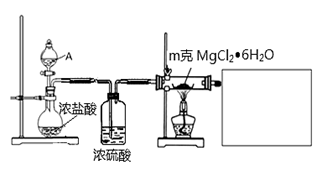
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________。
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是______________________。为增大气体产率,在下图装置的基础上,提出一点改进措施__________________。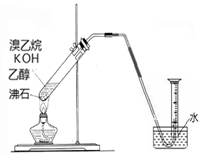
从实验安全角度考虑,该实验很可能发生的问题是________________。
三个化学小组的同学测定某Na2CO3固体样品(仅含NaOH杂质)的纯度,他们提出了各自的气体分析法。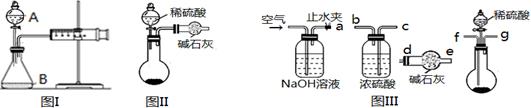
(1)第一小组用图I所示装置,仪器A的名称 。把m1 g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是 。
(2)第二小组用图II装置测定CO2的质量。该装置存在明显缺陷是 。
(3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的仪器如图III,装置的连接顺序是a— (填写接口字母,图中仪器可重复使用)。实验中取了样品m1 g,称量干燥管质量为m2 g,与足量稀硫酸反应后称量干燥管质量为m3 g,则Na2CO3的纯度表达式为 。
根据原电池的知识回答下列问题。
(1)下图烧杯中溶液为稀硫酸,则观察到Al上的现象是 。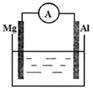
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应为: 。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为 。
(4)铅蓄电池放电时反应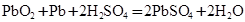 ,若放电消耗2mol硫酸时电路中转移电子_________mol
,若放电消耗2mol硫酸时电路中转移电子_________mol
已知:
| 药品名称 |
熔点/℃ |
沸点(℃) |
密度g/cm3 |
溶解性 |
| 正丁醇 |
-89.5 |
117.7 |
0.8098 |
微溶于水、溶于浓硫酸 |
| 1-溴丁烷 |
-112.4 |
101.6 |
1.2760 |
不溶于水和浓硫酸 |
根据题意完成下列填空:
(一)制备1-溴丁烷粗产品在如图装置的圆底烧瓶中依次加入NaBr,10 mL 正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1).写出制备1-溴丁烷的化学反应方程式:__________________________
(2).反应装置中加入沸石的目的是__________________。配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3).反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4).若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是
(选填编号)。
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图装置蒸馏。
(5).收集产品时,控制的温度应在_________℃左右;区分1-溴丁烷精品和粗品的一种方法是____________________。
(6).实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。