[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
蓝色 黄色
试回答下列问题:
(1)欲使溶液由黄色变为蓝色,可采取的两种方法为:① ;② 。
(2)欲使溶液由蓝色变为绿色,可采取的两种方法为:① ;② 。
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: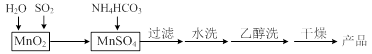
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、。
⑵①检验水洗是否合格的方法是。
②水洗结束后,用乙醇洗涤的目的是。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为;图中点D对应固体的成分为(填化学式)。
下图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。已知X、Y、Z是日常生活中常见金属单质,X由地壳中含量最高的金属元素组成;D、E是常见气态非金属单质,其中D呈黄绿色。A的焰色反应呈紫色(透过蓝色钴玻璃),F的稀溶液呈蓝色。
请回答下列问题:
⑴ C的电子式为。
⑵ I露置于空气中,颜色由白色迅速变成灰绿色,最终变成红褐色,该反应的化学方程式为。
⑶ X与C溶液反应的离子方程式为。
⑷ 写出J与Y反应的化学方程式,并标出电子转移的方向和数目:。
⑴探究物质的结构有助于对物质的性质进行研究。
① 下列物质中含有醇羟基的是(填字母)。
a.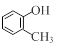 b.
b. c.
c.
② 下列物质分子中所有原子处于同一平面的是(填字母)。
a.溴苯 b.丙烯 c.甲醇
③ 欲区分HCHO和HCOOH,应选用(填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.NaHCO3溶液
⑵有机化学中的同分异构现象十分普遍。
① C3H6O的一种有机物能与新制的氢氧化铜悬浊液反应,该有机物的结构简式为。
② 有机物C5H10O2属于羧酸类的同分异构体有种,其中一种的核磁共振氢谱图(1H核磁共振谱图)中显示两个峰,该有机物的结构简式为。
③环状化合物M(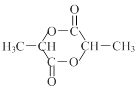 )由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
)由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
⑶科学家常采用将药物连接在高分子载体上,制成缓释长效药物。已知某种解热镇痛类药物的结构简式为A,把它连接到高分子聚合物B上,形成缓释长效药物C。
A: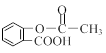 C :
C :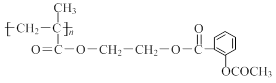
① HO-CH2-CH2-OH的名称为。
② 高分子聚合物B的单体的结构简式为。
③ A与B反应生成C的反应类型是。
④ 在酸性条件下,A可水解成CH3COOH和(填结构简式)。
请写出检验A是否已水解的实验方法和现象。
化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略如:加热等)
已知以下信息:
A属于芳香烃,H属于酯类化合物。
I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)B的结构简式,C的官能团名称。
(2)B C;G
C;G J两步的反应类型 ,。
J两步的反应类型 ,。
(3)①E+F H的化学方程式。
H的化学方程式。
②I G 的化学方程式。
G 的化学方程式。
(4)H的同系物K比H相对分子质量小28,K的同分异构体中能同时满足如下条件:
①属于芳香族化合物
②能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。
K的一个同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式。
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)B,D可分别与A形成只含一个中心原子的共价化合物X和Y,其中X的电子式为;Y采取的杂化轨道类型为;C与A形成的常见化合物的分子构型为。
(2)B和D的最高价氧化物的晶体中熔点较高的是(填化学式),其原因。
(3)B与C比较电负性较大的是(填元素符号),E2+的核外电子排布式为。
(4)E2+与C的常见氢化物形成的配离子的离子反应方程式为。
(5)铝单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。若已知铝原子半径为d,NA表示阿伏加德罗常数,摩尔质量为M,则该原子的配位数,该晶体的密度可表示为______________,据下图计算,Al原子采取的面心立方堆积的空间利用率为 __________。