越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟。一些“毒奶粉”竟然顶着国家“免检产品”桂冠。某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7. 8倍,长期食用可能致癌。NaNO2有像食盐一样的咸味,能发生如下反应:
2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是______,若有1.75 mol的还原剂被氧化,则被还原的氧化剂是_______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒。进行实验时,必须选用的物质有________。(填编号)
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂__________能使NaNO2转化为不引起二次污染的N2。(填编号)
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为____________________________________________。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
写出石墨Ⅰ电极上发生反应的电极反应式 ,
N2O5在电解池的 区生成(填“阳极”或“阴极”)。
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如下图:
(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置下图模拟“联合制碱法”的第一步反应.

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL.则纯碱样品中NaHCO3质量分数为 .
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如右图所示。温度高于900℃时,NH3产率下降的原因是 。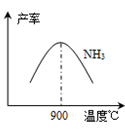
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是___________;
(2)写出有关离子方程式:
步骤①中生成A:____________;步骤②生成沉淀I:__________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.