几种短周期元素的原子半径及其某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
| 常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是 。
(4)DB2的结构式 。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式: 。
已知: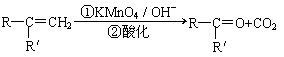 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是__ ______,名称是___ _____。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________ _________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_____________________、____________________。
(5)A转化为B和F的化学方程式是______________________。
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。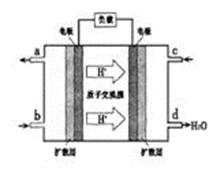
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol液态 H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)反应的热化学方程式为。
(2)又已知16g液态肼与液态双氧水反应生成液态水时放出的热量是408 kJ。则H2O(g)=H2O(l)
的ΔH=。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为_____ _____________________。
(10分,每空2分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6试回答下列问答:
(1)步骤①加入的指示剂是。
(2)步骤②应使用式滴定管。
(3)判断达到滴定终点的实验现象是;
(4)氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
| A.酸式滴定管未用标准盐酸溶液润洗 |
| B.锥形瓶未用待测液润洗 |
| C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了 |
| D.滴定时将标准液溅出锥形瓶外 |
(12分,每空2分)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) 。
(2)混合后溶液中由水电离出的c(OH-)为
(3)常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
| A.[Cl-]>[NH4+]> [H+] > [OH-] |
| B.[NH4+]>[Cl-]>[OH-]>[H+] |
| C.[Cl-]=[NH4+]>[H+]=[OH-] |
| D.[NH4+]>[Cl-]>[H+]>[OH-] |
(4)由电离常数可知酸性强弱: CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为:(填序号)
①CH3COONa ②NaHCO3 ③Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是。
(6)Cu(OH)2(s)  Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到。