设NA为阿伏加德罗常数,下列说法正确的是
| A.2.3g金属钠变为Na+时失去电子数目为0.1NA |
| B.32g氧气所含的原子数为NA |
| C.0.1mol•L-1氯化钡溶液中Cl-数目为0.2NA |
| D.11.2L氯气所含的原子数目为NA |
已知碘盐的主要成分是KIO3和NaCl,KIO3能与NaHSO3发生反应:2KIO3 + 6NaHSO3 ="=" 2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是()
| A.23Na37Cl中质子数和中子数之比是8:7 | B.KIO3和NaCl都是强电解质 |
| C.KIO3作氧化剂被还原 | D.生成1mo1 KI时,转移6 mo1电子 |
下列离子方程式正确的是()
A.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+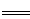 2Fe3++2H2O 2Fe3++2H2O |
| B.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-==BaSO4↓+H2O |
| C.向硫酸铝溶液中加入过量氨水:Al3+ + 3OH-==Al(OH)3↓ |
D.向NaHCO3溶液中加入足量Ba(OH)2的溶液:Ba2++2HCO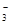 +2OH-===2H2O+BaCO3↓+ CO +2OH-===2H2O+BaCO3↓+ CO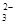 |
下列溶液中的Cl-物质的量浓度与100ml 1 mol·L-1AlCl3溶液中Cl-物质的量浓度相等的是
| A.150ml 1 mol·L-1氯化钠溶液 | B.75ml 2 mol·L-1氯化镁溶液 |
| C.50ml 6mol·L-1氯化钾溶液 | D.50ml 1 mol·L-1氯化铁溶液 |
下列有关实验的叙述正确的是()
| A.向沸水中滴加过量饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 |
| B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C.分液时的分液漏斗的下端与过滤时漏斗的下端均要贴紧烧杯内壁,其原因相同 |
| D.用量筒取5.0mL10 mol·L-1H2SO4溶液于50mL容量瓶中,直接加水稀释至刻度 |
下列说法正确的是()
| A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B.ⅠA族元素与ⅦA族元素间形成的化合物一定含离子键 |
| C.HF、HCI、HBr、HI的还原性依次增强,热稳定性依次减弱 |
D.元素铯的两种核素 多4个质子 多4个质子 |