(4分)已知:
① ══
══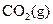
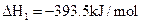
②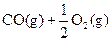 ══
══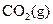
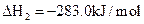
(1)反应 ══
══ △H= kJ/mol;
△H= kJ/mol;
(2)18g碳在空气不足时发生不完全燃烧生成CO,损失热量约为 kJ。
(本题10分)
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命。
已知:当反应条件为光照且与X2反应时,通常是X2与烷或苯环侧链烃基上的H原子发生的取代反应,而当反应条件为催化剂存在且与X2的反应时,通常为苯环上的H原子直接被取代。
下面是M5纤维的合成路线(部分反应未注明条件):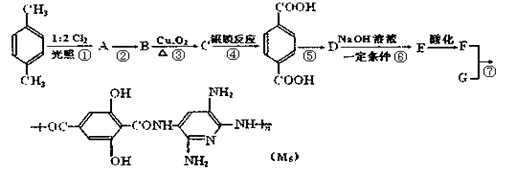
根据上述合成M5纤维的过程,回答下列问题:
(1).合成M5的单体的结构简式为______,;F的含氧官能团的名称有_____。
(2).在①~⑥的反应中,不属于取代反应的是______,反应②的条件是_______。
(3).生成A的同时可能生成的A的同分异构体为。
(4).1mol的C和足量新制的氢氧化铜悬浊液反应可以生成_________mol砖红色沉淀。
(5).1mol的F和Na2CO3溶液反应最多消耗Na2CO3mol。
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g)2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
…… |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
…… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
(本题12分)
磷是重要的非金属元素。磷单质及其化合物在工业生产中有着广泛的应用。
次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空
(1).磷原子的最外层电子排布的轨道表示式为 ______;氧原子核外电子云有 种不同的伸展方向,其最外层有 种不同运动状态的电子。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为。
(2).写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式。
(3).磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是__________________________________________________。(请用文字描述)
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。
(4).写出该反应的化学方程式__________________________。
(5).每消耗24.0g碳时,有mol电子发生转移。反应所得混合气体,折算成标况下,其气体密度为g/L。
(15分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因
是 (用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g)  ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(10分)溴水中存在化学平衡:Br2 + H2O HBr + HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)。已知:R-CH2Cl + NaOH(水溶液) → R-CH2OH + NaCl
HBr + HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)。已知:R-CH2Cl + NaOH(水溶液) → R-CH2OH + NaCl
回答下列问题:
(1)写出B中所含官能团名称 。
(2)指出③的反应类型 ,写出I(环状)的结构简式 。
(3)写出反应 ① 的化学方程式 。
写出反应 ② 的化学方程式 。