以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。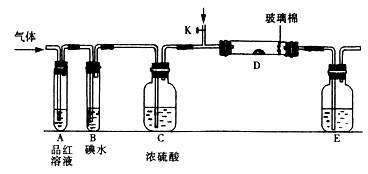
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙溶液 |
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
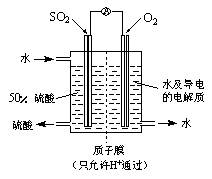
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
通入SO2的电极为_________极,其电极反应式为:
。
电池的总反应式为:
。
水体污染的危害是多方面的,它不仅加剧水资源短缺,而且严重危害人体健康。请判断下列说法是否正确(填“√”或“×”)。
 (1)工业废水中含有的酸、碱、盐,会造成水体污染。
(1)工业废水中含有的酸、碱、盐,会造成水体污染。
(2)生活污水中不含工业污染物,因此可以不经处理任意排放。
(3)含重金属(Hg、Pb、Cd、Cr等)的水,对人类健康有害。
(4)含大量N、P的污水任意排向湖泊和近海,会出现水华、赤潮等问题。
下表是某食品包装上的说明,表中列出了部分配料。配料中,富含维生素的是(填序号,下同),属于着色剂的是,属于防腐剂是,属于调味剂的是。
| 品名 |
浓苹果汁 |
| 配料 |
① 浓缩苹果汁 ② 蔗糖 ③ 柠檬黄 ④ 山梨酸钾 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装封口处 |
请仔细观察两种电池的构造示意图,
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,
则负极的电极反应式:。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其可能的原因是。
(3)原电池可将化学能转化为电能。某课外活动小组设计两种类型的原电池,以探究其能量转化效率。
限选材料:ZnSO4(aq), CuSO4(aq);铜片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注。
(要求:在同一烧杯中,电极与溶液含相同的金属元素)
②组装原电池乙,要求:以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中,工作一段时间后,可观察到负极。
③甲乙两种原电池中可更有效地将化学能转化为电能的是,(填“甲”或“乙”),其原因是。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g)ΔH= -196.6kJ·mol-1
2SO3(g)ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH= -113.0kJ·mol-1
2NO2(g)ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1molSO3的同时生成1mol NO |
若测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
(4)依据燃烧的反应原理,合成的甲醇可以设计如图乙所示的原电池装置。
① 该电池工作时,OH-向极移动(填“正”或“负”)。
② 该电池正极的电极反应式为。
在室温下,下列五种溶液:
① 0.1 mol/L CH3COONa②0.1 mol/L CH3COONH4
③0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl等体积混合
⑤0.1 mol/L NH3·H2O⑥0.1 mol/L NH4Cl
请根据要求填写下列空白:
(1)溶液①呈(填“酸性”、“碱性”或“中性”),其原因是(用离子方程式表示)。
(2)比较溶液②和③,其中c(NH4+)的大小关系是②______③(填“>”、“<”或“=”)。
(3)在混合液④中,c(Cl-)="________" mol/L;c(NH3·H2O)+ c(NH4+)______ 0.2 mol/L(填“>”、“<”或“=”)。
(4)室温下,一定体积的溶液⑤和溶液⑥混合后所得溶液的pH=7,则溶液中离子浓度的大小关系是:。