一卤代烃RX与金属钠作用,可以增加碳链制取高级烃。反应的化学方程式为
RX+2Na+R′XR R′+2NaX其中X表示卤原子,R和R′表示为烃基,可以相同,也可以不同。试以苯、乙炔、Br2、HBr、Na为主要原料通过三步反应制取
R′+2NaX其中X表示卤原子,R和R′表示为烃基,可以相同,也可以不同。试以苯、乙炔、Br2、HBr、Na为主要原料通过三步反应制取 。其制取的化学方程式为:
。其制取的化学方程式为:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________。
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母).
| A.向水中加入NaHSO4 |
| B.向水中加入Na2CO3 |
| C.加热水至100℃[其中c(H+)=1×10-6 mol/L] |
| D.在水中加入(NH4)2SO4 |
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈性(填“酸”、“碱”或“中”);若用pH计测定,则pH7(填“>”、“<”或“=”),溶液呈_性(填“酸”、“碱”或“中”).
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO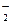 、MnO
、MnO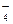 、CO
、CO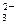 、SO
、SO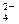 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验: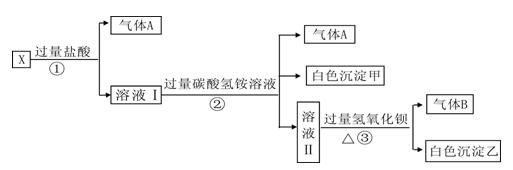
(1)白色沉淀甲是。
(2)X溶液中一定存在的离子是。
(3)白色沉淀乙中一定有:,可能有证明其是否存在的方法是。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟 用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。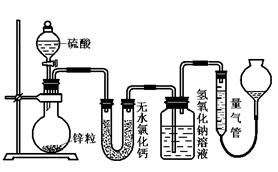
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方
程式为:________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到Vml气体,则有:ag/65g·mol-1=bg/64g·mol-1+V ml/ 22400 ml·mol-1,依据的原理是。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)= (用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
n(H2)/n(SO2)的数值将(填偏大、偏小或无影响)
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①
②
③
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的原子的结构示意图为,它的最高化合价为。
(2)B的化学式(分子式)为,B的晶体类型为。
B和碳反应生成A和E的化学方程式是。
(3)C的化学式(分子式)为,D的化学式(分子式)为。
BAD是一种紫外线吸收剂,其合成方法如下: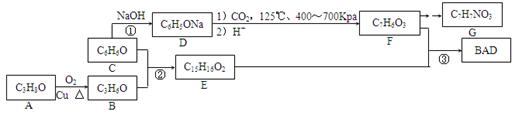
已知:
Ⅰ、B分子中所有H原子的化学环境相同;
Ⅱ、BAD的结构为: 。
。
请回答下列问题:
(1)A的名称为。
(2)F的结构简式为。F的一些同分异构体能使氯化铁溶液变色,能发生银镜反应,且苯环上的一硝基取代产物有两种。符合上述条件的同分异构体有种。
(3)反应②的化学方程式为;反应③在一定条件下能直接进行,其反应类型为。
(4)G是一种氨基酸,且羧基和氨基处于苯环的对位。写出G缩聚产物可能的结构简式(只要求写一种)。