(1)由2个C原子、1个O原子、1个N原子和若干个H原子组成的共价化合物,H的原子数目最多为_________个,试写出其中一例的结构简式_______________________。
(2)若某共价化合物分子只含有C、N、H三种元素,且以n(C)和n(N)分别表示C和N的原子数目,则H原子数目最多等于_________。
(3)若某共价化合物分子中只含有C、N、O、H四种元素,且以n(C)、n(N)和n(O)分别表示C、N和O的原子数目,则H原子数目最多等于。
(12分)请用化学(或离子)方程式解释以下事实或原理:
(1)盛装NaOH溶液的试剂瓶不能用磨口玻璃塞:__________________________。
(2)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用离子方程式表示该反应原理:。
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:
该氧化物与盐酸反应的化学方程式:___________________________________。
该氧化物与氢氧化钠溶液反应的离子方程式:____________________________。
(4)工业上用焦炭高温还原二氧化硅制备粗硅的化学方程式:____________________。
(5)红色金属铜置于潮湿空气中,一段时间后固体表面由红色变为绿色化学方程式:
____________________。
下列物质的转化或分离是用哪种方法实现的?
| A.分馏 | B.干馏 | C.蒸馏 | D.电解 E.过滤 F.裂化 |
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等;
(2)从原油中分离出汽油、煤油、柴油等 ;
(3)将海水淡化;
(4)除去粗盐溶液中的泥沙;
(5)从NaCl饱和溶液得到NaOH和Cl2及H2过程;
(6)石油炼制过程为了提高汽油的质量,即获得更多的轻质液体燃料,采用方法;
咖啡酸A是某种抗氧化剂成分之一,A与FeCl3溶液反应显紫色
(1)咖啡酸中含氧官能团的名称为_________________________________________。
(2)咖啡酸可以发生的反应是____________________________________(填写序号)。
①氧化反应②加成反应③酯化反应④加聚反应⑤消去反应
(3)咖啡酸可看作1,3,4—三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为______________________________________。
(4)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为:
___________________________________________________________________。
(10分) 有机物A的结构简式是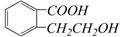 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B.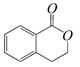 C.
C.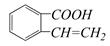
D.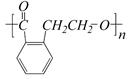 E.
E.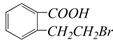
(1)A中含氧官能团的名称:
(2)写出由A制取B的化学方程式:
(3)写出A制取C、D、E三种物质的有机反应类型:C DE
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不同):
、
有机物X、Y、Z都是芳香族化合物, X与Z互为同分异构体,Y的分子式为C9H8O,试回答下列问题。
(1)X是一种重要的医药中间体,结构简式为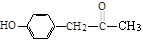 ,X可能发生
,X可能发生
的反应有___________________。
a.取代反应 b.消去反应 c.氧化反应 d.水解反应
(2)有机物Y有如下转化关系: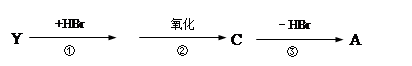
其中Y不能跟金属钠反应;A能跟NaHCO3溶液反应,能使溴的四氯化碳溶液褪色,且苯环上只有一个取代基。
Y的结构简式为______________________或_________________________。
(3)Z可由A经一步反应制得。
① Z的结构简式为______________________或_________________________;
② Z有多种同分异构体,其中属于饱和脂肪酸的酯类,且苯环上只有一个侧链
的同分异构体有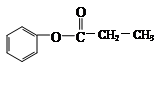 、__________________________、
、__________________________、
_________________________________、_____________________________。