要除去表中所列有机物中的少量杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(Ⅰ)试剂:a.NaCl固体;b.NaOH溶液;c.生石灰;d.Na2CO3溶液;e.水;f.浓溴水;g.KMnO4溶液
(Ⅱ)方法:
| A.过滤; | B.萃取; | C.蒸馏; | D.分液;E.盐析;F.重结晶 |
| 要提纯物质(杂质) |
CH3CH2Br(CH3CH2OH) |
C2H5OH(H2O) |
肥皂液(甘油) |
C6H5Br(Br2) |
C6H6(C6H5OH) |
| 选用试剂(Ⅰ) |
|
|
|
|
|
| 分离方法(Ⅱ) |
|
|
|
|
|
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:
_____________________________________________________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):____→____→____→____。
(3)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是_________,
B瓶溶液的作用是_______,可用_______代替,C瓶溶液的作用是________________。
(4)装置②中所加的固体药品是____________,可验证的产物是____________,确定装置②在整套装置中位置的理由是______________。
(5)装置③中所盛溶液是_____________,可验证的产物是__________。
(6)如果按照①②③的顺序连接,可以检出的物质是_________,不能检出的是_________;
如果按照②③①的顺序连接,可以检出的物质是_________,不能检出的是_________;
如果按照①③②的顺序连接,可以检出的物质是_________,不能检出的是_________;
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示: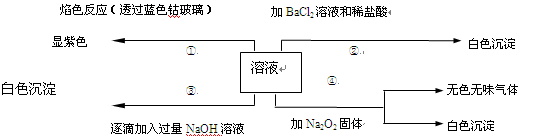
在第③个实验中,生成白色沉淀的量与加入NaOH的量有
图所示的相互关系。据此可知:
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
_______________________ ___ ______
。
某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式 。
(2)试设计实验证明溶液X中含过氧化氢 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2 + Fe2+ + OH-— Fe(OH)3¯,该反应中H2O2表现了 性(填“氧化”或“还原”)。
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了 性(填“氧化”或“还原”)。
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验制取SO2的反应。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用_______________________________________。
②措施:为确保C中的实验现象发生,在B、C之间加一个装有_________________的洗气瓶,作用_______________________。
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是__________________。
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
①提出合理假设:
假设1:白色固体为Na2SO3;假设2: ;
假设3:白色固体为Na2SO3与Na2SO4的混合物。
②设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入,塞上单孔胶塞,将生成的气体通入。 |
若,说明白色固体含有Na2SO3,则成立,若无该现象, 则成立。 |
| 步骤2:在步骤1反应后的溶液加入。 |
若,则说明白色固体含Na2SO4。 结合步骤1的结论,则成立,若无该现象,则则成立。 |
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)写出A中发生反应的化学方程式。
(2)① 装置B中盛放的试剂为,作用是。
②装置D和E中出现的不同现象说明的问题是。
③写出装置G中发生反应的离子方程式。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在和之间(填两个装置字母序号),装置中应放入
(填写试剂或用品名称)。
(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量g。