高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O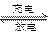 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
| A.放电时负极反应为:Zn-2e-+2OH-====Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-====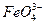 +4H2O +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
下列观点正确的是 ( )
| A.化合物电离时,生成的阴离子是氢氧根离子的是碱 |
| B.某化合物的熔融状态能导电,该化合物中一定有离子键 |
| C.某化合物的水溶液能导电,该化合物一定是电解质 |
| D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 |
下图所示的实验,能达到实验目的的是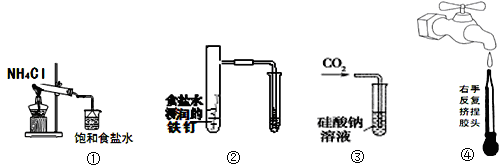
| A.实验①制取的氨气溶解在饱和NaCl溶液 |
| B.实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 |
| C.实验③可用于证明碳的非金属性比硅强 |
| D.图④是实验室洗涤胶头滴管的操作 |
下列日常生活中的现象与氧化还原反应无关的是( )
| A.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B.用石膏点豆腐 |
| C.不良商贩用硫黄熏蒸法制作“白豆芽” |
| D.自来水厂用氯气对水进行消毒 |
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应,下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.6mol |
| B.反应后产生13.44L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.8mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)
| A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O |
B.该消毒液的pH约为12:ClO-+H2O HClO+OH- HClO+OH- |
| C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O |
| D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- |