将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
| A.1∶2∶3 | B.3∶2∶1 |
| C.6∶3∶1 | D.6∶3∶2 |
以下一定能说明化学平衡发生移动的是
| A.正、逆反应速率改变 | B.加入催化剂 |
| C.增大压强 | D.反应转化率的改变 |
氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)  F—(aq) + H2O(l)△H=-67.7 kJ/mol
F—(aq) + H2O(l)△H=-67.7 kJ/mol
H+(aq) + OH—(aq)  H2O(l)△H=-57.3kJ/mol
H2O(l)△H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是()
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1) 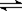 H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
下列实验过程中曲线变化正确的是()
| A.①表示Na2CO3溶液中滴入稀盐酸 |
| B.②表示溴水中滴入Na2SO3溶液 |
| C.③表示AgNO3溶液中滴入氨水 |
D.④表示一定条件下2SO2+O2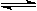 2SO3△H<0达平衡后,升高温度 2SO3△H<0达平衡后,升高温度 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1: 3的化合物,常温下YX3是一种刺激性气味的气体。下列说法正确的是()
| A.原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B.W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业 |
| C.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D.已知YX3沸点远高于YZ3,则Y—X键的键能高于Y—Z键 |
将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是( )
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |