有机物A是一种重要化工生产的中间体,已知结构简式为 :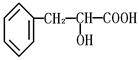
(1)A中含的官能团有:
(2)A可能具有的化学性质有: (填写序号)
① 能与H2发生加成反应 ②能与甲醇发生酯化反应 ③能与甲酸发生酯化反应
④ 在浓硫酸和加热的条件下发生消去反应 ⑤能与A g(NH3)2OH溶液发生氧化反应
(3)在一定条件下,用有机物A可以合成高分子化合物C [(C9H8O2)n ]。请写出反应的化学方程式(要求有机物写结构简式):
。
下图中各图象表示N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):
2NH3(g)(正反应为放热反应)达到平衡后,只改变一个条件时建立的新平衡的过程。填写下列各空(均填写图序号):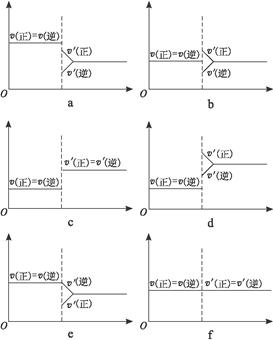
(1)表示减少H2而建立新的平衡的是图_______________;
(2)表示压缩气体体积后建立新的平衡的是图_______________;
(3)表示降低温度而建立新的平衡的是图_______________;
(4)表示体积不变充入N2、H2,同时分离出NH3建立新的平衡的是图_______________;
(5)表示加入催化剂建立新的平衡的是图_______________;
(6)表示充入氩气(体积不变)后,建立新的平衡的是图_______________。
在一个固定体积的密闭容器中加入2 mol A和1 mol B,发生如下反应:
2A(g)+B(g) 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为w mol·L-1。若维持容器体积和温度不变,用下列物质作为起始物质时,经反应达平衡后C的浓度(填“大于”“小于”或“等于”):
(1)加入1 mol A和1 mol B时,C的平衡浓度___________________________w mol·L-1。
(2)加入2 mol A和1 mol B,3 mol C和1 mol D时,C的平衡浓度___________w mol·L-1。
(3)加入3 mol C和1 mol D时,C的平衡浓度_____________________________w mol·L-1。
(4)加入2 mol B、3 mol C、1 mol D时,C的平衡浓度_____________________w mol·L-1。
(4分)常温下,浓度均为0.1 mol·L-1的①NaHCO3②NaClO③NH4Cl④NaCl⑤Na2CO3五种溶液的pH由大到小的顺序是___________。
过氧化氢H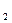 O
O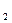 可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H
可用于采矿业废液消毒,如消除采矿废液中的氰化物时发生如下反应(已配平):KCN+H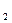 O
O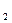 +H
+H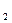 O
O
 +NH
+NH ↑。请完成下列问题:
↑。请完成下列问题:
(1)生成物A的化学式可表示为___________________________。
(2)该反应是氧化还原反应吗?____________。若是,则氧化剂是__________;若不是,请说明理由。
以下离子方程式均不正确,请改正。
(1)氧化铜与盐酸反应:O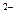 +2H
+2H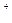
 H
H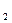 O。正确的离子方程式是___________。
O。正确的离子方程式是___________。
(2)碳酸钡加入稀盐酸中:CO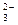 +2H
+2H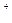
 CO
CO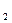 ↑+H
↑+H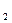 O。正确的离子方程式是___________________________________________________________________。
O。正确的离子方程式是___________________________________________________________________。
(3)铝粉加入硫酸铜溶液中:Cu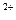 +Al
+Al Cu+Al
Cu+Al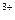 。正确的离子方程式是________。
。正确的离子方程式是________。
(4)亚硫酸和氢氧化钡溶液混合:Ba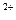 +SO
+SO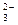
 BaSO
BaSO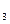 ↓。正确的离子方程式是__________________________________________________________________。
↓。正确的离子方程式是__________________________________________________________________。