(4分)常温下,浓度均为0.1 mol·L-1的①NaHCO3 ②NaClO ③NH4Cl ④NaCl ⑤Na2CO3五种溶液的pH由大到小的顺序是___________。
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。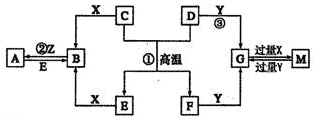
(1)写出X的电子式:。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为(写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式:。
(4)写出反应③的离子方程式:。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别(回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明。
以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮
请根据以上信息回答下列问题:
(1)烃A的结构简式为 ,A的化学名称为__________。
(2) 由B生成C的化学方程式为 。
(3) C的同分异构体中,既能与FeCl3溶液发生显色反应,又能发生银镜反应的有机物共有______种,其中在核磁共振氢谱中出现五组峰的有机物的结构简式为___________。
(4) D的结构简式为 ,D的某同分异构体中含有苯环的碳酸二酯在酸性条件下发生水解反应的化学方程式为 。
Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图___________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式____________。
Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示,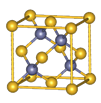
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为。
(4)AsH3空间构型为 。
已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是_______。
(5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g/mol,阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式_________ g/cm3。
I.目前,我国采用“接触法”制硫酸,设备如图所示: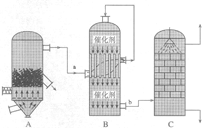
(1)图中设备A的名称是_____________,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_____(填字母序号)。
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II.纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于,“氨碱法”中CO2来源于。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式:。
氮元素及其化合物在国防科学技术生产中有重要应用。
(1)写出实验室制NH3的化学反应方程式
(2)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 。
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
(4)在容积为2L容器中发生反应CO(g)+H2O(g) CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(CO)与反应时间t变化曲线Ⅱ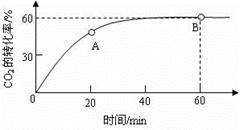
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素时,当氨碳比 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”)
②NH3的平衡转化率为 。