按要求填空:
(1)除去下列物质中所混有的少量杂质,写出有关的反应方程式。
①Fe2O3中混有少量SiO2 ;
② NO中混有NO2 。
(2)为什么不能用加热NH4Cl固体的方式制取氨气(用化学方程式表示): 。
(3)将1.92g Cu投入到100mL某浓度的硝酸溶液中,观察到产生红棕色气体,随着反应的进行,气体颜色逐渐变浅。铜完全反应完后,共收集到1.12L气体(标准状况下测定),则此时参与反应且未被还原的硝酸物质的量为 ;所产生的气体中NO2的体积分数为 。
(15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。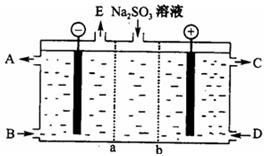
①图中a表示离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示,E表示。
②阳极的电极反应式为。
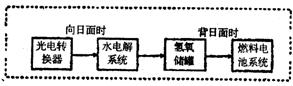
I.我国即将建成自己的载人空间站。载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。
⑴某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的某极反应为:4OH--4e-=O2↑+2H2O,则另一极反应为:。
⑵有人提出,可以设计某温度下的反应:2CO=2C+O2(△H>O、△S<O)来消除CO的污染。请你判断该温度下上述反应是否能发生并说明理由是。
Ⅱ.大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
⑴有关大气固氮(以N2+O2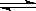 2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数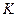 的值如下表。
的值如下表。
| 反应 |
N2+02 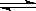 2NO 2NO |
N2+3H2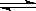 2NH3 2NH3 |
||
| 温度/℃ |
27 |
2000 |
100 |
400 |
| K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
⑵已知:N2(g)+3H2(g) 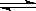 2NH3(g)
2NH3(g)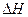 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)="2H20(1)" 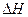 ="-571.6" kJ·mol-1
="-571.6" kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的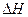 =KJ·mol-1。
=KJ·mol-1。
⑶某研究小组在673 K、30 MPa下,在体积为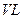 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g)  2NH3(g),其
2NH3(g),其 (H2)和
(H2)和 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。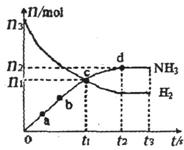
①下列叙述正确的是。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则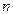 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)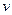 (H2)=。
(H2)=。
③若开始时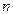 (N2)=
(N2)=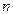 (H2),则反应的平衡常数
(H2),则反应的平衡常数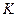 =(用代数式表示)。
=(用代数式表示)。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下: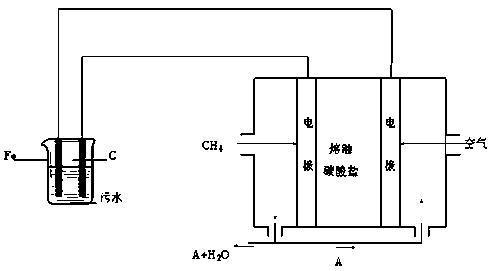
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是①;
②4OH- - 4 e-= 2H2O +O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答: ;。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti:将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s)+2Cl2 (g)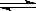 TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1所以不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1所以不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4)已知:C(s)+O2 (g) = CO2 (g) ; ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g);ΔH= ______________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
随着石油价格的提高,化学工作者正在研究以天然气和醇类合成优质汽油的方法。合成路线如下: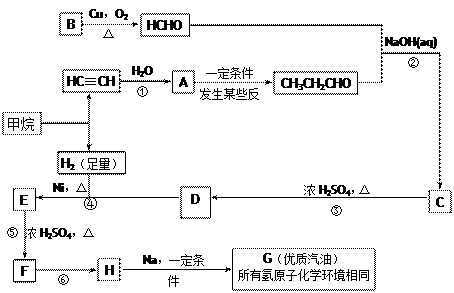
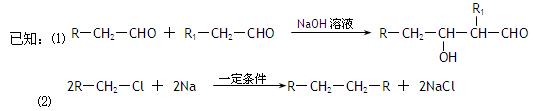
试回答下列问题:
(1)在反应①—⑦中,属于加成反应的是,属于消去反应的是。
(2)写出下列反应的化学方程式E→F;H→G
(3)C的具有相同官能团的同分异构体(包括C)有种。
(4)根据题给信息,写出用乙炔和苯及必要的无机试剂合成对二苯基环丁烷(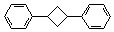 )的合成路线如下:
)的合成路线如下: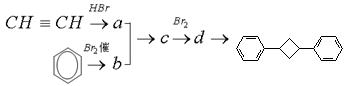
请写出a、b、c、d的结构简式:a; b; c; d.