(15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式: ,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰 kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是 。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。 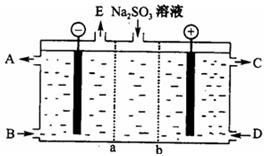
①图中a表示 离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示 ,E表示 。
②阳极的电极反应式为 。
在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡的体积/mL |
硫酸氢钠的体积/mL |
溶液的PH |
| ① |
33.00 |
0.00 |
8 |
| ② |
33.00 |
X |
7 |
| ③ |
33.00 |
33.00 |
6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”);
(2)b=,X=;
(3)反应③的离子方程式为:;
(4)将此温度下的Ba(OH)2溶液取出1 mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH-)。
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体。有关物质间的转化关系如下(图中部分反应物或产物已省略):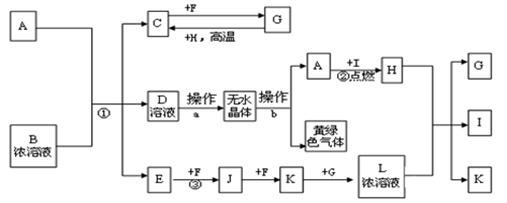
请填空
(1)B的电子式,B物质的水溶液呈,原因是(用离子方程式表示)
(2)反应①的离子反应方程式为
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为
(4)K+G+F→L写出该反应的化学方程式,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式。
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容。
(1)请写出实验室制取NH3的化学方程式;
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因
(用离子方程式和简要的文字说明);
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的_________,若外界条件为标准状况,所得氨水的物质的量浓度为________;
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理。设计成NH3—O2燃料电池,碱性条件下该电池负极电极反应为:。
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点。“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺。
Ⅰ、热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
C |
| 反应物投入量 |
1molCO2(g)和 3molH2(g) |
1molCH3OH(g)和 1molH2O(g) |
2molCO2(g)和 6mol H2(g) |
| CH3OH(g)浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应能量变化 |
放出29.4 kJ |
吸收a kJ |
放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为mol/(L· s)(用具体数值表示);
②a=。c1c2 1/2c3(填“>”“<”或“=”)。
Ⅱ、CO可用于合成甲醇。在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示:
CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示: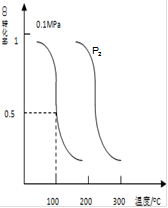
(1)该反应属于反应(填“吸热”或“放热”);P20.1MPa(填“>”“<”或“=”);
(2)100℃时,该反应的平衡常数K=(用含a、b的代数式表示)。
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,下列示意图不能说明反应在进行到t1时刻达到平衡状态的是(填字母序号)。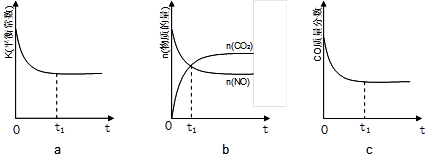
草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为。
(2)滴定过程中操作滴定管的图示正确的是。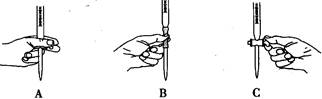
(3)本滴定达到终点的标志是:;
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度,(填“偏高”、“偏低”、或“不变”)。
Ⅱ、草酸氢钠溶液显酸性,常温下,向10 mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是:。
| A.V(NaOH)=0时,c(H+)= 1×10-2 mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)= 1×10-7 mol/L |
| D.V(NaOH)>10mL时, c(Na+)> c(C2O42-)> c(HC2O4-) |