“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH >0
Fe(s)+CO2(g) ΔH >0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向_______进行(填“左”或“右”),判断依据是
。
(2)一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)。
已知:2CO(g) + O2(g)=2CO2(g) ΔH =–566 kJ·mol―1
2H2O(g) =2H2(g) + O2(g) ΔH =+484 kJ·mol―1
CH3OH(g) + 1/2O2(g)=CO2(g) + 2H2(g) ΔH =–192.9 kJ·mol―1
请写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
。
(3)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。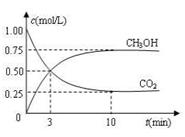
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ _;
②反应达到平衡后,下列措施能使 增大的是______(填符号)。
增大的是______(填符号)。
| A.升高温度 | B.再充入H2 | C.再充入CO2 |
| D.将H2O(g)从体系中分离 E.充入He(g) |
图是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作步骤流程图(图中略去了沉淀物的洗涤操作),请在图中圆括号内填入适当的试剂名称,在方括号内填入适当的分离方法,并回答有关问题。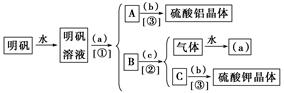
(1)试剂a是________,b是________,c是________;分离方法①是________,②是________,③是________。
(2)进行上述操作①要用到的玻璃仪器有____________________________________________
________________________。
(3)按上述操作,不考虑损耗,在理论上158 g明矾(式量474)最多可以制得Al2(SO4)3·18H2O(相对分子质量666)____________g,制得的K2SO4的质量至少应大于(相对分子质量174)____________g。
下面是海水提镁的流程图: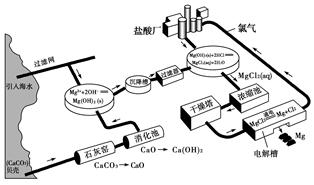
请回答下列问题:
(1)海水提镁要用到海滩上的贝壳。那么,贝壳在生产流程中起什么作用?
________________________________________________________________________
________________________________________________________________________;
其主要成分发生化学变化的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)从海水中的镁离子到金属镁,经历了哪些化学变化?用离子方程式表示。
(3)在用上述方法提镁的过程中,采用了哪些措施来提高经济效益?
从海水中提纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是
________________________________________________________________________
________________________________________________________________________。
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是_______________________________________ _________________________________。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是(填写代号):________。
| A.H2 | B.CO2 | C.空气 | D.O2 E.水蒸气 |
海水中镁的总储量约为1.8×1015吨,而目前世界上利用的镁60%来自海水。如图是海水提取镁的工艺流程图。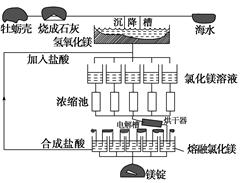
根据上面的图示,回答下列问题:
(1)请写出海水提取镁的工艺流程中属于分解反应的一个化学方程式:
________________________________________________________________________。
(2)工业上采用电解熔融MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:
________________________________________________________________________。
(3)上述制备镁的工艺流程中,适合循环经济的做法是
________________________________________________________________________。
(4)工业上制取金属铝时用电解__________(填原料)的方法,试解释铝电解槽中的阳极碳棒为何要定期更换?
________________________________________________________________________
________________________________________________________________________。
(1)据《科技消息报》报道:由于废气排放致使地球南极上空的a层出现了400多万平方公里的空洞,有害宇宙线长驱直入,把b分解,密度较小的氢就会逃逸到宇宙空间,剩下的氧最终会使土壤c,从而使地球人类正在重蹈火星的覆辙。根据以上叙述,回答问题。
①填充:a____b____c_____。
②写出a与b对应的化学方程式:a_________b________。
(2)据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面积的40%。研究结果还表明,酸雨对我国农作物、森林等影响区域大。
如图是研究酸雨成因的学生实验用的“催化棒”。用两根外面套有玻璃管的粗导线穿过橡皮塞并固定于粗玻璃管中,在其中一端用电热丝连接起来,即制成“催化棒”。
实验时,先接通直流电源,使电热丝红热,然后将红热的电热丝伸入装有SO2和空气的集气瓶中,瓶中立即出现_____ 现象,再往其中加入盐酸酸化的氯化钡溶液,又出现______现象。
请回答:
①以上实验中可得出酸雨成因的化学原理是_________。
②目前一座中等城市每年用煤约300万吨,其含硫量如按1%计算,则每年排放SO2多少吨?若此二氧化硫有60%转化为硫酸,相当于生成多少吨98%硫酸?
③为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式______,并比较此法与将“石灰石粉未与含硫煤混合”使用防治酸雨的方法,哪个更好些?答_________(填“生石灰法”或“石灰石法”)
④如每隔一段时间测定某份雨水(酸雨)样品的pH,请作出有关时间与酸雨pH变化的曲线图。
⑤国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式______。