某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++ SO32-+H2O=2Fe3+ + SO42-+2H+;二是发生双水解反应2Fe3++3SO32-+6H20=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ、学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干,从选择的药品分析,作者设计这个实验的目的是 。
实验Ⅱ、取5mL FeCl3浓溶液于试管中,逐滴加入NaSO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为 。另一份中加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅲ、换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述实验得出的结论是 。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液于氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是_______________________________________。
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式:___________________________________
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(用离子方程式和简要文字表述):__________________________________________________________________
(4)某化学学习小组为定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100 mL,加入25 gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol·L-1 NaOH溶液、8.0 mol·L-1 NaOH溶液、澄清石灰水、0.01 mol·L-1 KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、小木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2;
假设2:气体是________________;
假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 将气体依次通入盛有________、________的洗气瓶中,________ |
__________________ |
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为________________。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验Ⅰ中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
①气体成分为________ |
| 实验Ⅲ |
②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ |
③________________ __________________ __________________ |
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
④溶液中存在________ |
(3)为进一步确定实验Ⅰ的产物,设计定量实验方案,如图所示: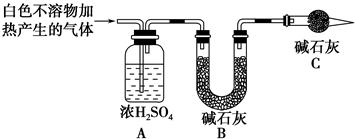
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式:__________________________ ______________________________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:____________________________________。
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:__________________。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为_________________________________。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。
按如图装置连接好仪器(暂不装入药品),___________________ ____。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,_______________________________________________,
即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 |
预期现象和结论 |
(5)实验结论:铁与氧化铁反应的化学方程式为___________________________
草酸(H2C2O4)是一种弱酸,在工业中有重要作用。某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁,热水浸泡,经过滤得到溶液,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,然后对生成的沉淀进行探究。
(1)草酸盐溶液呈弱碱性的原因是_____________________________________。
(2)该同学对生成的沉淀进行定性探究。
①提出合理假设。
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:___________________________________________________________。
②基于假设2,设计实验方案,进行实验。请在下表中写出实验步骤以及预期现象和结论。限选实验试剂:
1 mol·L-1 H2SO4、0.1 mol·L-1盐酸、0.01 mol·L-1 KMnO4溶液、澄清石灰水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入_________________________________ ________________________________ |
_______________________________ _______________________________ 说明沉淀中有CaCO3 |
| 步骤2:_________________________ ________________________________ |
________________________________ |
(3)基于假设3,另一位同学对生成的沉淀进行定量探究。用稀盐酸溶解生成的沉淀,并加水配制成100 mL溶液。每次准确移取25.00 mL该溶液,用0.010 mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。若菠菜样品的质量为m g,则菠菜中草酸及草酸盐(以C2O42—计)的质量分数为________。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是_______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。(填序号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。