( 12分 ) 如图所示的装置用于制备1,2 -二溴乙烷 ( 广口瓶中的NaOH溶液是为了吸收副反应产生的SO2等 ) ,请回答下列问题: 
( 1 ) 加热混合物至170 ℃ 左右是为了 ____________________ 。
( 2 ) 广口瓶中NaOH溶液过量,写出吸收SO2反应的化学方程式 ___________________ 。
( 3 ) 使用水作冷却剂是为了什么?
( 4 ) 烧瓶中的混合液加热时先变棕色后变黑色是由于 _________________________ 。
( 5 ) 烧瓶中放些白瓷片,其作用是什么?
( 6 ) 生成的1,2 -二溴乙烷通常混有过量的溴,为洗去溴最好用 ______________ 。
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:
(已知:MnO4-在酸性环境下的还原产物是Mn2+)
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4·2H2O) g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和 .
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如下表所示:
| 试管1 |
试管2 |
|
| 实验现象 |
褪色很快 |
褪色很慢 |
| 褪色时间/s |
4秒 |
31秒 |
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是: .
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为: .
③同学测出的颜色变化的时间是以下列哪个选项为依据的 .
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是 .
于是甲同学得出结论 .
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:
I II
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称:
①__________________;
②__________________;
④__________________;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是①_______________________②_________________________。
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样2.50g,将样品配成250mL的待测液。
(2)滴定管使用前除洗涤外,还应 。
(3)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(4)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 直到滴定终点。
(5)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
10.40 |
| 第二次 |
10.00 |
4.00 |
14.10 |
| 第三次 |
10.00 |
4.20 |
15.70 |
(6)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
实验题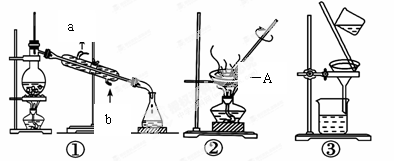
I.(1)写出上图中A仪器的名称___________(2)冷凝管的进水口为_____________(填字母)
Ⅱ.实验室要配制2 mol/L稀硫酸240 mL。
(1)量取浓硫酸时,用下面那种规格的量筒____________(填序号)
①10 ml②50 ml③100 ml④500 ml
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有 、 、 等.
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数_____________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处_____________;
③ 容量瓶事先有水,没干燥_____________
III.200ml 5mol/lNaOH溶液中含溶质的质量是 g,取出20 ml溶液,其溶质的物质的量浓度是 。将取出的溶液稀释至100 ml,其溶质的物质的量浓度是 。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:
【探究一】
(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________。
(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y。
①甲同学认为X中可能含有Fe3+和Fe2+。若要确认其中的Fe2+,应选用__________(填序号)。
a.KSCN溶液 b.铁氰化钾溶液 c.盐酸
②乙同学取448mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为____,充分反应后,加入足量BaC12溶液,经适当操作后得干燥固体2.33g。可推知气体Y中SO2的体积分数为__________。
【探究二】
据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究。
(3)装置A中的现象是 ,其作用是________________。
(4)为判断CO2是否存在,需将装置M添加在______________(填序号);
a.A之前 b.A~B之间 c.B-C之间 d.C~D之间
若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为__________。
(5)若C中固体变红,D中固体变蓝,则Q是___________(填化学式),产生该气体的原因是__________。
(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为__________(填序号)。
a.SO2 b.H2、SO2c.H2、 CO2 d.CO2、SO2 e.CO2、SO2、H2