某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? |
①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 |
① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 |
验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 |
使红色布条褪色的物质是 。 |
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是_______;若用碳酸钠固体与稀硫酸反应应选用的装置是_______。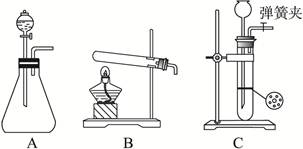
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题: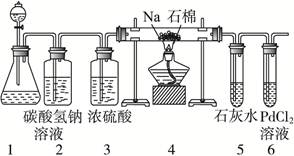
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有Na2O和C。
某化学课外小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
| A.大理石 | B.盐酸 | C.氢氧化钠溶液 | D.澄清石灰水。三名同学设计的制备实验方案的反应流程分别如下: |
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3溶液
Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________________________。
乙方案_______________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________________。
(3)假设反应③所得的NaHCO3溶液中含有Na2CO3。现要利用A~D四种试剂证明Na2CO3的存在,你所选择的试剂有_________________(填试剂代号在题干中)。
(4)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的?(填“能”或“不能”)。若能,请说明其计算需要的数据;若不能,请简要说明理由。
_____________________________________。
(12分)如图,把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处。片刻后发现试管中气体颜色_______________,试管中的液面___________,试管壁上有_____________出现,还观察到水槽中______________。
(15分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
| 结构简式 |
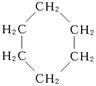 |
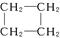 |
Br—CH2—CH2— CH(CH3) —CH2—Br |
| 键线式 |
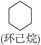 |
 |
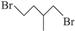 |
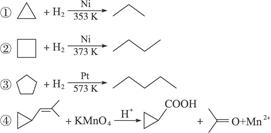
请完成下列问题:
(1)环烷烃与______________是同分异构体。
(2)从反应①—③可以看出,最容易发生开环加成反应的环烷烃是______________(填名称)。判断依据为____________________________________________________________________。
(3)环烷烃还可以与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为______________________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法。所用试剂是______________;现象与结论是___________________________________________________________________________。
(8分)现有四种烃:①C2H6 ②C2H4 ③C2H2 ④C6H5CH3
(1)易发生取代反应的烃是(填序号,下同) ___________,易发生加成反应的是___________。
(2)碳碳键的键长由长到短的顺序为___________。
(3)在空气中燃烧时,能产生浓烟的是___________,其原因是___________。
(4)将其通入(或滴入)KMnO4酸性溶液中,能使之褪色的有______________________。
(5)③与HCl的反应产物在一定条件下合成高分子化合物的反应方程式为________________。
(6)④与浓H2SO4、浓HNO3反应生成TNT的化学方程式为____________________________。