已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3,根据下列框图转化回答问题: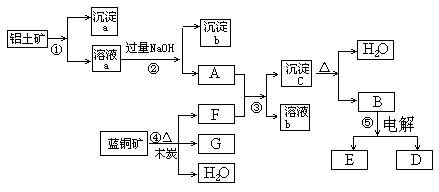
(1) 写出②的离子方程式:______________________、_____________________。
(2) 沉淀a、c化学成分分别是: ___ ___、__ ____。
(3)请写出检验沉淀b中所含有阳离子的实验方法_______________________________
(4)洗涤沉淀c的实验操作方法是____________________________________________
加热沉淀c应放在___________容器中进行。
(5) 经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:______________________、_________ ___________________________________。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。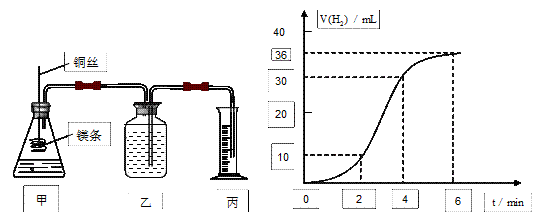
图1图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在下图的方框中画出上述反应的速率与时间的关系曲线。(请在图上标明相应的数值)
|
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。


 (1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
(1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。 其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=kJ·mol-1。 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则反应2NO2(g) N2O4(g)的平衡常数K=
N2O4(g)的平衡常数K=
 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
 (1)图中A、C分别表示 、
(1)图中A、C分别表示 、
,E的大小对该反应的反应热(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H(填“变大”、“变小”或“不变”),理由是 (2)图中△H=KJ·mol-1;
(2)图中△H=KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式 、 。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式 、 。 (4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=
在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应: 3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
⑴B的平衡浓度为。
⑵A的转化率为。
⑶用D表示的平均反应速率为。
⑷如果缩小容器容积(温度不变),则平衡体系中混合气体的密度、平均相对分子质量。(两空均填“增大、“减少”或“不变”)
城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它有煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式,该反应是反应(填吸热、放热)。
(2)设液化石油气的主要成分为丁烷(C4H10),其充分燃烧后产物为C02和H2O,试比较
完全燃烧等质量的C4H10及CO所需的氧气的质量比(结果保留1位小数)。