某溶液中可能含有H+、Na+、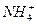 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
水处理技术在工业生产和日常生活中有着重要应用。
(1)水处理絮凝剂包括无机絮凝剂和有机絮凝剂。无机絮凝剂如明矾,其原理用离子方程式表示为;有机絮凝剂如聚丙烯酸钠。 (2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(3)高铁酸钠(Na2FeO4)作为水处理剂兼具絮凝剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。Na2FeO 4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。
4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。
某芳香烃X是一种重要的有机化工原料,有机化合物Y的分子式为 ,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。
,它们能按下图所示转化关系生成某种长效缓释阿司匹林(方框内物质均为有机物,无机产物已略去)。其中,E能使溴的四氯化碳溶液褪色,且分子中有1个甲基;G的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基,1 molG与足量金属钠作用产生H222.4 L(标准状况)。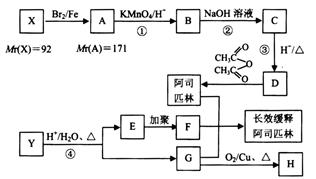
已知:
(i)阿司匹林又名乙酰水杨酸: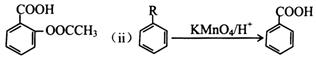
请回答:
(1) X的结构简式为__________, H分子中官能团的结构简式为__________;
(2) 反应②的化学方程式为__________,
反应①可否调至反应②、③之后进行?__________(选填“可以”或“不可以”),
请简述理由:___________________________________;
(3) 写出一种同时满足以下条件的D物质的同分异构体的结构简式_______________;
a.能发生银镜反应 b. 1个分子中含3个含氧官能团
c.苯环上一氯代物只有2种 d. 1mol有机物最多可消耗2mol NaOH
(4) 反应④的化学方程式为_______________;
(5) 阿司匹林、有机物F和G嫁接形成某种长效缓释阿司匹林,它能持续缓慢地释放出乙酰水杨酸,使人体能长时间存在乙酰水杨酸,用于抗血栓治疗。写出该长效缓释阿司匹林的结构简式_______________。
甲、乙分别是两种主族元素形成的氧化物,它们广泛存在于地壳中,均不溶于水,且都有如下相 同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
同的转化关系,不同之处是乙对应的转化过程中需控制盐酸用量,若盐酸过量则得不到白色沉淀B。
(1) 写出甲、乙的化学式:甲________,乙________;
(2) 写出下列反应的化学方程式:
甲+NaOH溶液____________________________________________,
乙+NaOH溶液____________________________________________;
(3) 分别写出甲、乙对应的A溶液与过量盐酸反应的离子方程式:
甲 ________________________________________
乙______________ ______________________________
______________________________
(4) 若将5.1g乙溶于适量的盐酸(二者恰好完全反应)后,再加入175 mL的2 mol.L-1NH3H2O溶液,得到沉淀___________g
常温下,用 0.1000 mol L-1NaOH溶液滴定 20.00 ml0.1000 mol.L-1CH3COOH溶液,所得滴定曲线如下图所示。
请回答:
(1) 有人认为,C点时NaOH与CH3COOH恰好完全反应,这种看法是否正确______?(选填“是”或“否”),理由是________________________;
(2) 关于该滴定实验,从下列选项中选出最恰当的一项____ (选填字母);
(3) 在B点时,溶液中 ________
________ (选填“>”、“<”或“=”);
(选填“>”、“<”或“=”);
(4) 在A〜D区间内,下列大小关系可能存在的是________;
①
②
③
④
(5) 若向该醋酸溶液中加入少量的醋酸钠晶体,则溶液的pH会____(选填“增大”、“减小”或“不变”);
(6) 常温下,用该NaOH溶液滴定25.00 mL—定浓度的某稀H2SO4溶液,达到滴定终点时消耗NaOH溶液的体积为25.00 mL,则该稀H2SO4溶液的pH=____。
有一种融雪剂,其主要成分的化学式为XY2, X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是;Y与氢元素形成的化合物的电子式是。
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D原子的电子排布式;D与E能形成一种非极性分子,该分子的立体构型名称为。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是。