在一个容积不变的反应器中,要求调节体系的温度使下列反应达到平衡时,保持容器内气体的总物质的量为12 mol。
已知反应A(g)+2B(g) 2C(g),现向容器中加入6.5 mol A、x mol B、2.0 mol C。
2C(g),现向容器中加入6.5 mol A、x mol B、2.0 mol C。
(1)若x=5.5时,需要降低体系的温度使反应在平衡时达到题设条件,则正反应为_______(填“吸热”或“放热”)反应。
(2)欲使起始反应维持向逆反应方向进行,则x的取值范围为_________。
(3)在一定温度下的上述平衡体系中,另按1∶2 的物质的量之比通入D和E两种气体(此时容器内气体的总物质的量不要求保持12 mol),按下式反应:D(g)+E(g) 2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入m mol D\,n mol F和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为________mol(设A、B、C与D、E、F之间均不反应)。
2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入m mol D\,n mol F和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为________mol(设A、B、C与D、E、F之间均不反应)。
标准状况下,往100mL0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是多少?
为了测定某铜银合金成分,将30g合金完全溶于80ml13.5mol/L的浓硝酸中,待反应完全后,收集到6.72L气体(标况),并测得溶液中H+浓度是1mol/L.假设反应后溶液体积仍为80ml,求合金中银的质量分数.
硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得S22-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与S22-也完全转化为S2O32-。问: S+SO2+OH-完全转化为S2O32-的离子方程式____________________
S+SO2+OH-完全转化为S2O32-的离子方程式____________________ amol S最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
amol S最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________ 若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为 _________。
_________。

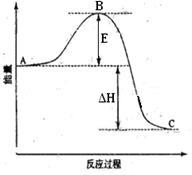




 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的
ΔH=-99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;
 (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
 (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
 (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
请回答下列问题:




 (1)判断该反应达到平衡状态的标志是 。(填字母)
(1)判断该反应达到平衡状态的标志是 。(填字母) a.SO2和SO3浓度相等 b.SO2百分含量保持不变
a.SO2和SO3浓度相等 b.SO2百分含量保持不变 c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等 e.容器中混合气体的密度保持不变
e.容器中混合气体的密度保持不变 (2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母) a.向装置中再充入N2 b.向装置中再充入O2
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.生高温度
c.改变反应的催化剂 d.生高温度 (3)求该反应达到平衡时SO3的转化率(用百分数表示)。
(3)求该反应达到平衡时SO3的转化率(用百分数表示)。 (4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?