某同学从一种未知的无色溶液中检验出有Ba2+、Ag+,同时溶液的酸性较强,他还准备继续检验溶液中是否含有Cu2+、Cl-、CO32-、K+、SO42-、NO3-等离子。显然,有些离子还必须检验,有些离子已不需检验。你认为还必须检验的离子有
。
硝基苯甲酸乙酯在
存在下发生水解反应:
 .两种反应物的初始浓度均为0.050
,15
时测得:
的转化率
随时间变化的数据如表所示。回答下列问题:
.两种反应物的初始浓度均为0.050
,15
时测得:
的转化率
随时间变化的数据如表所示。回答下列问题:
| 0 |
120 |
180 |
240 |
330 |
30 |
600 |
700 |
800 |
|
|
/% |
0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
(1)列式计算该反应在120~180
与180~240
区间的平均反应速率、。比较两者大小可得到的结论是。
(2)列式计算15
时该反应的平衡常数。
(3)为提高
的平衡转化率,除可适当控制反应温度外,还可以采取的措施有(要求写出两条)。
4种相邻的主族短周期元素的相对位置如表,元素
的原子核外电子数是
的2倍,
的氧化物具有两性。回答下列问题:
(1)元素
在周期表中的位置是第周期、第族,其单质可采用电解熔融的方法制备。
(2)
、
、
三种元素最高价氧化物的水化物中,酸性最强的是,碱性最强的是.(填化学式)
(3)气体分子
的电子式为,
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是。
是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度
的催化下,探究
浓度对
分解反应速率的影响。限选试剂与仪器:30%
、0.1
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验
分解反应方程式并标明电子转移的方向和数目:
②设计实验方案:在不同
浓度下,测定(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。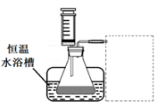
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图
和
中的信息,按图
装置(连能的
、
瓶中已充有
气体)进行实验。可观察到
瓶中气体颜色比
瓶中的(填"深"或"浅"),其原因是。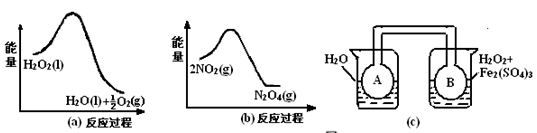
石墨在材料领域有重要应用。某初级石墨中含
(7.8%)、
(5.1%)、
(3.1%)和
(0.5%)等杂质。设计的提纯和综合应用工艺如下:
(注:
的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入
前,需通一段时间的
,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100
初级石墨最多可获得
的质量为
。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
用
代替
与燃料
反应,既可以提高燃烧效率,又能得到高纯
,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①
②
③
(1)反应
的
(用
表示)。
(2)反应①~③的平衡常数的对数
随反应温度
的变化曲线见图18.结合各反应的
,归纳
曲线变化规律:
a)
b)
(3)向盛有
的真空恒容容器中充入
,反应①于900 ºC达到平衡,
平衡(
)=8.0×10-5
,计算
的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的
,可在初始燃料中适量加入。
(5)以反应①中生成的
为原料,在一定条件下经原子利用率100%的高温反应,可再生成
,该反应的化学方程式为;在一定条件下
可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为。