同量Al2(SO4)3分别与适量下列溶液反应,可能生成沉淀的物质的量最大的是_______,沉淀质量最大的是________。
| A.NH3·H2O | B.NaAlO2 | C.NaOH | D.Ba(OH)2 |
(14分)数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1①
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1③
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是
;该气化气可在适当温度和催化剂下合成液体燃料甲醇,该反应方程式为
(3)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。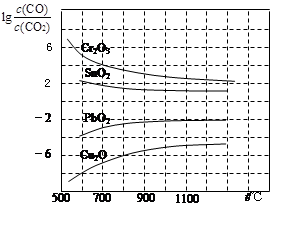
下列说法正确的是
| A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
(4)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,则其阳极的电极反应式为
2CO+O2,则其阳极的电极反应式为
(5)将CO通入银氨溶液中可析出黑色的金属颗粒,写出反应方程式
(15分)纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
(1)“溶解”过程需要的玻璃仪器有,“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是。为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加(填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为;
该制法的副产品为(填化学式);若称取11.1克无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是
②CaO2的质量分数为(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“偏高”、“偏低”、“无影响”、“不能确定”)。
(12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,通入肼的一极为极,该极的电极反应式是。电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
F和G是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到: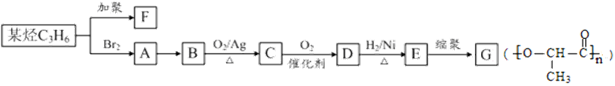
请回答下列问题:
(1)F的名称是,G中所含官能团的名称
(2)A→B的反应条件是D→E的反应类型是
(3)C的结构简式为
(4)H为C的同分异构体,且符合下列条件,其结构简式为
①能使酸性高锰酸钾溶液褪色②能与NaHCO3溶液反应放出气体
(5)E→G的化学方程式是
(12分)硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式开始沉淀的pH分别为:2.7,5.4,7.6;完全沉淀的pH分别为:3.7,6.5,9.7。
(1)下列能提高浸取过程中浸出效率的措施有
| A.将矿石粉碎 | B.提高浸取温度 | C.适当增加硫酸的浓度 | D.搅拌并适当延长浸取时间 |
ZnO和硫酸反应的离子方程式为
(2)加入适量锌粉后溶液中存在的金属阳离子主要有
(3)氧化过程中H2O2发生反应的化学方程式为
(4)加入适量Ca(OH)2调节溶液pH至~(填范围),促进Fe3+水解完全。Fe3+水解反应的平衡常数表达式K=