(14分)数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1 ①
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1 ②
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1 ③
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是
;该气化气可在适当温度和催化剂下合成液体燃料甲醇,该反应方程式为
(3)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。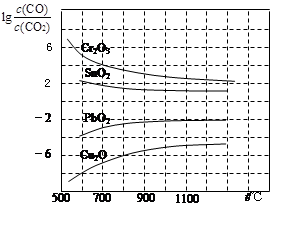
下列说法正确的是
| A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
(4)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,则其阳极的电极反应式为
2CO+O2,则其阳极的电极反应式为
(5)将CO通入银氨溶液中可析出黑色的金属颗粒,写出反应方程式
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| |
Q |
R |
|
| T |
|
|
W |
(1)T的原子结构示意图为_______________________。
(2)元素的非金属性为(原子的得电子能力):Q__________R(填“强于”或“弱于”)。(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______________。
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,B的产量是衡量一个国家石油化工发展水平的标志,他们之间并能进行如图所示的相互转化。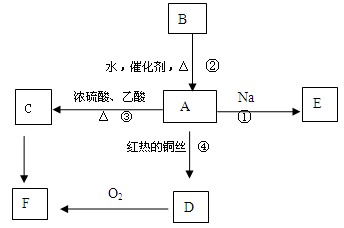
(1)写出A的结构简式 ,F中所含决定化学性质的原子团的名称为
(2)下列反应的化学方程式并注明反应类型
反应①: ,反应类型
反应②: ,反应类型
反应③: ,反应类型
反应④: ,反应类型
(6分)(1)按要求在下列空格中填出下列有机物的有关式子:
①最简单烯烃的结构式:,
②食醋中的有机物结构式:,
③糖尿病患者尿液中含的糖类物质的结构简式:
(2)下面列出了几组物质,请将物质的合适序号填写在空格上。
同位素,同素异形体,同分异构体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦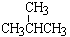 和
和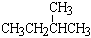 ;⑧
;⑧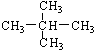 和
和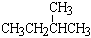 ;
;
A、B、C、D、E、F均为元素周期表前20号主族元素,其核电荷数依次增大。其中A、B同周期,B、D同主族且相邻,A、B、D三种元素的核电荷数之和为30。C、E同周期,可形成1:1型的离子化合物。F的最外层电子数大于1。请回答:
(1)A、B、C、D、E、F六种元素的元素符号分别为_________________________;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
A、B、C均为短周期元素,它们在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
| A |
C |
|
| B |
(1)A、B、C三种元素的名称分别为_________、__________、________;
(2)B元素位于元素周期表中第______周期第____族;
(3)C元素的原子结构示意图为____________,
(4)A、B、C三种元素的原子半径从大到小排列顺序为________(用元素符号表示)