根据下图所示的A、B、C、D、E 五种物质的相互转化关系,按如下关系填写相应的物质和有关反应的化学方程式:
(1)当A是气体单质时,B是_________,C是____________,E是______________,由D 生成E的反应的化学方程式是__________________。
(2)当A是固体单质时,A是_________,B是____________,D是______________,由E 生成C的反应的化学方程式是__________________。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积 (填“大于”“等于”或“小于”)100 mL。欲使剩余的铜片继续溶解,可在其中加入硝酸盐,该反应的离子方程式是 。
(3)分别将等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论):
。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加 ,该过程的现象为 。
(2)步骤②加入过量H2O2的目的是
。
(3)步骤③中反应的离子方程式是
。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、
、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为 g。
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为
。
(2)过程Ⅰ加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是
。
(3)过程Ⅱ中发生反应的化学方程式为 。
(1)用稀硫酸浸泡由黄铜矿(主要成分CuFeS2)冶炼铜得到的滤渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(2)铜在自然界存在于多种矿石中,如
| 矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
| 主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
①上表所列铜化合物中,铜的质量百分含量最高的是 (填化学式)。
②工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是 。
6Cu+SO2↑,该反应的氧化剂是 。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。已知:SiO2溶于NaOH溶液生成Na2SiO3和H2O,CaSiO3是沉淀。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: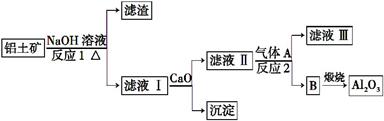
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: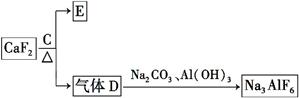
回答下列问题:
(1)写出反应1的化学方程式 。
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为
。
(3)E可作为建筑装饰的材料,化合物C是 ,由D制备冰晶石的反应中另外一种生成物气体是 。
(4)电解制铝的化学方程式是 。