在一定条件下可实现下图所示物质之间的变化

请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是 。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式 。
(4)每生成1mol D同时生成 mol E。
异甘草素具有抗肿瘤、抗病毒、抗自由基、抑制脂质过氧化等生物活性。异甘草素的合成方法如下:
已知:I有机物A的化学式为C7H8O,1H核磁共振谱图表明,它有四类谱,其比为3:2:2:1。
请回答:
(1)写出下列物质的结构简式A,D。
(2)写出B→C反应类型,步骤①在合成过程中的作用是。
(3)写出C经③与NaOH反应的化学方程式。
(4)B的同分异构体有多种,写出符合下列要求的2种同分异构体的结构简式、。
a.遇FeCl3溶液显紫色
b.能发生银镜反应
c.苯环上一氯取代产物仅有一种
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是。
A.共价键 B.离子键
C.金属键 D.氢键
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是。
;回流管中冷水流从口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是。
(3)母液处理方案1可以是(用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
(选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称 取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至
取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至 滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式:MnO4-+H2O2+H +=MnO2++H2O+
+=MnO2++H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为。
燃油中所含硫以二硫醚的形式存在,工业上常用催化如氢的方法脱硫,然后综合利用生产硫酸。如二硫丙醚(C3H7-S-S-C3H7)脱硫综合利用的有关的应为:
C3H7-S-S-C3H7(g)+3H2(g)=2C3H8(g)+2H2S(g)△H1(反应1)
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)△H2<0(反应2)
2SO2(g)+O2(g)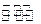 2SO3(g)△H3=-196kJ·mol-1(反应3)
2SO3(g)△H3=-196kJ·mol-1(反应3)
SO3+H2O=H2SO4
已知某些化学键的键能数据如下表:
| 化学键 |
C-C- |
C-H |
H-H |
S-H |
S-S |
S-C |
| 键能/kJ·mol-1 |
a |
b |
c |
d |
e |
f |
(1)则△H1=kJ·mol-1(用字母式表示)。
(2)反应2能自发进行的条件是。
(3)反应3的平衡常数表达式为:K=。既能提高SO2的转化率,又能加快反应速率的措施是。
(4)以硫酸作电解质的铅蓄电池,其充、放电原理可用下列化学方程式表示:
Pb+PbO2+2H2SO4 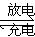 2PbSO4+2H2O
2PbSO4+2H2O
①放电时,硫酸的密度(填“增大”“减小”或“不变”)。
②充电时,阳极的电极反应式为。
现有A、B、C、D四种常见的短周期主族元素,它们之间的关系如下:
I.原子半径:A<C<B<D
II.原子的最外 层电子数:A+C=B+D=8
III.原子的核外电子层数:B=C=2A
IV.B元素的主要化合价:最高正价+最低负价=2
请 回答:
回答:
(1)由A、B两种元素组成的常见气体,其电子式为;只有A和B两种元素组成的属于离子晶体的化合物可能为(用化学式表示)。
(2)由D元素形成的氢氧化物,与强碱溶液反应的离子方程式为。
(3)由B、C元素组成的化合物BC3,该化合物具有强氧化性,与水反应生成两种酸和一种无色气体,该气体常温下遇空气变红棕色,写出该化 合物与水反应的化学方程式。
合物与水反应的化学方程式。
(4)由A、B和C三种元素组成的盐,常温下其水溶液显酸性,则0.1mol·L-1该盐溶液中浓度最大的离子为(写离子符号)。
(5)由A、B、C和D四种元素组成的配位化合物,其化学式为;写出检验该配位化合物中所含阳离子的实验方法。
DAP-A树脂是一种优良的热固性树脂,
被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥,对环境及人员无损害,性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。这种材料可采用下列路线合成: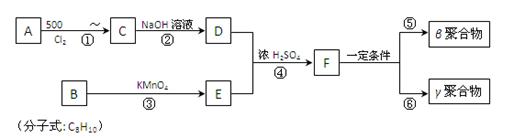

试回答下列问题:
(1)A的名称是_______________。
(2)在①~④的反应中属于取代反应的是。
(3)B的结构简式是______________________,B苯环上的一氯代物有种。
(4)写出反应②、⑤的化学方程式:
② 。
⑤ 。
(5)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是___________和_____________。