已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Z两种元素的符号:X__________、Z__________。
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的化学式分别为__________、__________、__________(写出其中的三种即可)。
(3)由X、Y、Z所形成的常见离子化合物是__________。它与W的最高价氧化物对应水化物的浓溶液加热时反应的离子方程式是____________________。
(4)在由X、Y、Z、W四种元素形成的常见化合物中,含有非极性共价键的离子化合物是______________________。
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓ (a)
ZnFe2(C2O4)3·6H2O↓ (a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O
Ⅱ.ZnSO4·7H2O
Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液D.KSCN溶液
②加入 。
A.纯锌粉B.纯碳酸钙粉末
C.纯ZnO粉末D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。
(1)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1
2SO3(g)ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0 kJ·mol-1
2NO2(g)ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g) 2CO2(g)+S(l)△H=—270 kJ/mol
2CO2(g)+S(l)△H=—270 kJ/mol
一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在催化剂作用下发生反应生成CO2(g)和S(l)。
①若反应进行到25min时测得CO2的体积分数为0.5。则前25min的反应速率v(CO)=_____;
②若反应进行到40min时反应达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8g/L,则化学平衡常数K=________;
③若反应在不同条件下进行,反应体系总压强随时间的变化如图甲所示:
图甲中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为_________(填实验序号);与实验a相比,c组改变的实验条件可能是__________;若用P0表示开始时总压强,P表示平衡时总压强,用α表示CO的平衡转化率,则α的表达式为______________。
(3)汽车尾气和工业废气中均含有的NO2,NO2是大气污染物之一。消除NO2的污染还可用电解法,方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 极,电解池中生成N2O5的电极反应式是 。
酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如图所示,则下列有关说法正确的是
| A.X的分子式为C12H13O3 |
| B.1molX最多只能与含1molNaOH的溶液反应 |
| C.X在一定条件下能发生加成反应、加聚反应和酯化反应 |
| D.可用溴水区分苯酚和X |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得: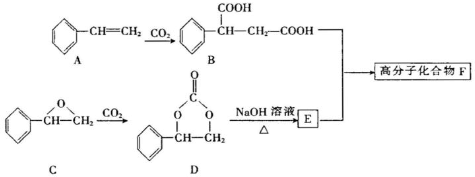
化合物B分子中官能团的名称为 ,0.1mol化合物A完全燃烧需要消耗 O2(标准状况下)。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,其中化合物Ⅰ能发生催化氧化,其氧化产物能发生银镜反应,则化合物Ⅰ的结构简式为 ;由化合物Ⅱ生成化合物Ⅰ的反应条件为 。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式: 。
(5)化合物Ⅲ的结构简式为 在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
【化学-有机化学基础】(13分)某兴趣小组以烃M等为主要原料合成药物普鲁卡因: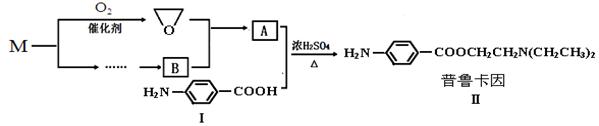
已知:①在标准状况下气体M的密度是1.25g/L。
②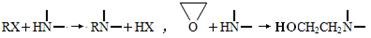 。
。
(1)M→ 的反应中原子利用率为100%,该反应的化学方程式为__________________,反应类型是___________。
的反应中原子利用率为100%,该反应的化学方程式为__________________,反应类型是___________。
(2)对于普鲁卡因,下列说法正确的是________。
| A.一个分子中有15个氢原子 |
| B.能与氢氧化钠溶液反应,但不与盐酸反应 |
| C.能发生加成反应、取代反应和氧化反应 |
| D.属于芳香族化合物 |
(3)A中含氧官能团的名称为 。化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式_____。
(4)符号下列条件的化合物Ⅰ的同分异构体有_______种。
①能发生银镜反应;
②遇氯化铁溶液显紫色
(5)请用化学反应方程式表示以M为原料制备B(无机试剂任选)的有关反应_______________。
【化学-物质结构与性质】(13分)X、Y、Z、W、Q五种元素的原子序数依次增大,已知X原子核外电子占3个不同能级,且每个能级上排布的电子数相同,Z原子L电子层上有2对成对电子,W元素的最高正价与最低负价的代数和为6,Q的+1价阳离子核外有3个电子层均处于全满状态。回答下列问题:
(1)X的基态原子最外层有____种不同运动状态的电子,Q+的基态核外电子排布式为_______;
(2)X、Y、Z三种元素的第一电离能由小到大的顺序为______(填元素符号),形成的最简单氢化物的熔点由低到高的顺序是_______(填化学式);
(3)YW3中心原子的杂化方式为________,其分子空间构型为________;
(4)X、Z两种元素形成的化合物XZ2分子中含有_____个σ键和______个π键;
(5)用晶体的x射线衍射法对Q的测定得到以下结果:Q的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为____;Q的原子半径是_____(阿伏加德罗常数为NA)。