有人设想合成具有以下结构的烃分子。
(1)结构D显然是不可能合成的,原因是 ;
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式 ;
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)下列有关烃的说法正确的是
a.不符合通式CnH2n+2的烃都一定含不饱和键;
b.烃分子中H原子个数不一定都比C原子个数多;
c.若知道了某烃的C、H原子个数比,只能得出该烃的最简式,不可能得出分子式;
d.烃分子中H%最高的是甲烷。
有X、Y、z、w四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子;W和 Y不属于同一主族。
(1)画出Y原子结构示意图:;
(2)从化合价角度分析,X元素可以排在周期表中I A、VIIA和族;
(3)Z、W两种元素最高价氧化物对应水化合物相互反应的化学方程式:;
(4)已知X2单质的热值为143 kJ·g-1,试写出X2单质在Y2单质中燃烧的热化学方程式:.
已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。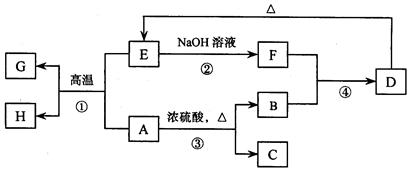
请填空:
(1)H的名称是。
(2)E的两种用途是、。
(3)反应③的化学方程式是。
(4)反应④的离子方程式是。
工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。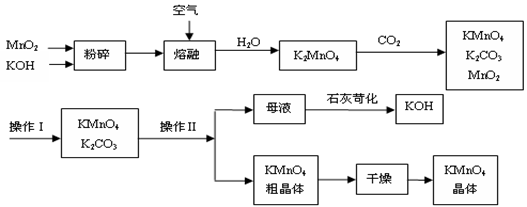
⑴KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
⑵上述流程中可以循环使用的物质有、(写化学式)。
⑶若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得mol KMnO4。
⑷操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。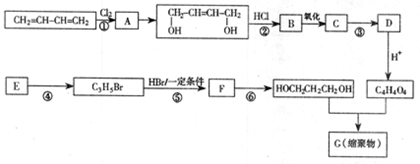
(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色。同温同压下,E的密度是H2的21倍。核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3。E的结构简式为。
(2)反应类型:①,④。
(3)反应条件:③,⑥。
(4)反应②、③的目的是。
(5)反应⑤的化学方程式为。
(6)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(7)G的结构简式为。
氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为。 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 |
△H(kJ/mol) |
| H2(g) |
-285.8 |
| CO(g) |
-283.0 |
| CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
,溶液中离子浓度从大到小的顺序是。