选修原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(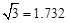 )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
中学化学中几种常见物质的转化关系如图19所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。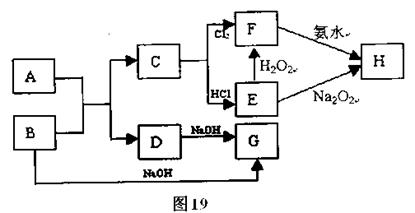
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围。
(2)写出D、E的化学式:D、E
(3)①写出H2O2的电子式:
②写出E的酸性溶液与双氧水反应的离子方程式。
(4)写出检验F中阳离子的实验操作、现象及有关反应的离子方程式。
实验操作;
现象,离子方程式。
(5)在E溶液中加入与E等物质的量的Na2O2能恰好使E转化为H,写出该反应的化
学方程式。
(本题14分)工业上用CO生产燃料甲醇。一定条件下发生反应: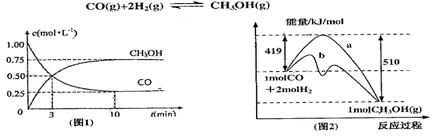
(1)图l是反应时CO和CH3OH(g)的浓度随时问变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率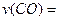 ;
;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表使用催化剂后的能量变化。该反应的焓变是(选填“△H<0”或“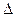 H>0”)反应,写出反应的热化学方程式;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;
H>0”)反应,写出反应的热化学方程式;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表 达式为,温度升高,平衡常数K(填“增大”、“不变”或“减小”);
达式为,温度升高,平衡常数K(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的。
增大的。
a.升高温度; b.充入He气
c.再充入1molCO和2mol H2 d.使用催化剂
K2EO4(E代表某种元素)是一种不常见的含氧酸盐,但在工业上有重要的应用,以下是制备该物质的工艺流程图: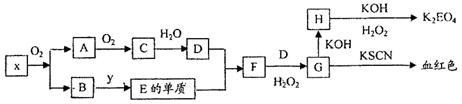
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是,H的化学式是。
(2)写出F→G的离子反应方程式
(3)要实现B→E的转化,y的化学式可能是
(4)H→K2EO4过程中H2O2的作用,lmol H转化为K2EO4时需H2O2的物质的量是。
(本题10分)下面是以化合物I为原料合成一种香精.(化合物VI)的合成路线,反应在一定 条件下进行。化合物Ⅵ广泛用于香精的调香剂。
条件下进行。化合物Ⅵ广泛用于香精的调香剂。
回答下列问题:
(1)化合物I生成化合物Ⅱ的反应原子利用率可达100%,化合物I的结构简式为
。
(2)写出化合物V合成化合物Ⅵ的反应方程式
(3)写出一种可鉴别化合物Ⅲ和Ⅳ的化学试剂:
(4)化合物V的多种同分异构体中,与化合物V官能团种类相同且无支链的共有种。(5)化合物Ⅵ不能发生的反应类型是
| A.加成反应 | B.酯化反应 |
| C.水解反应 | D.加聚反应 |
(本题6分)运送“神舟”五号飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为。
(2)该物质与液态双氧水反应能产生两种无毒又不污染环境的物质,写出该反应的化学方程式。
(3)NH3分子中的N原子有一对孤对电子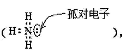 能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的方程式。
。