在相同条件下,一定量的氢气在氧气中充分燃烧并放出热量。若生成液态水放出的热量为Q1;若生成气态水放出的热量为Q2。那么Q1与Q2之间的大小关系是( )
| A.Q1>Q2 | B.Q1<Q2 |
| C.Q1=Q2 | D.不能确定 |
下列离子方程式表达正确的是()
| A.SO2通入溴水中溴水褪色:SO2 + 2H2O + Br2 =2H+ + SO2-4+ 2HBr |
| B.漂白粉溶液在空气中失效:ClO- + CO2 + H2O = HClO + HCO3- |
| C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性: Ba2++ 2OH-+ 2H++ SO2-4= BaSO4↓ + 2H2O |
| D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+ 3H+ = Fe3++ 3H2O |
NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.0.012千克石墨晶体中含共用电子对数目为2 NA |
| B.电解精炼铜时,若阴极得到电子数为2NA个,则阳极溶解的铜的质量为小于64g |
| C.常温常压下,32gO2和O3的混合气体所含原子数为NA |
| D.20℃、1.01×105Pa时,2.24L C2H4和CO的混合气体,含气体分子数为0.1NA |
工业废气的氮氧化物(NO、NO2等,用通式NOx表示)是主要的大气污染物之一。为了保护环境,工业上常通入氨气与之发生反应:NOx+NH3→N2+H2O(未配平)。有关此反应,下列说法中正确的是()
| A.当x=2时,有1 mol气体被还原,转移的电子为2 mol |
| B.当x=1时,每生成2.5 mol N2,被氧化的气体有4 mol |
| C.无论x为何值,N2既是氧化产物又是还原产物 |
| D.当x=2时,反应通式配平后H2O的化学计量数为8 |
下列各组离子在指定条件下,能大量共存的是()
①在含大量Fe3+的溶液中:NH+4、Na+、Cl-、SCN-
②使pH试纸变深蓝的溶液中:K+、CO2-3、Na+、AlO2-
③水电离的c(H+)=10-13 mol/L的溶液中:ClO-、CO2-3、NO-3、NH+4、SO2-3
④在加入铝粉能产生H2的溶液中:NH+4、Fe2+、SO2-4、NO-3
⑤使甲基橙变红的溶液中:MnO-4、NO-3、SO2-4、Na+、Fe3+
⑥能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH+4、S2-、Br-
| A.①③ | B.②⑤ | C.①②⑤ | D.③⑥ |
下列化学用语使用正确的是()
| A.HCN分子的结构式:H—C≡N | B.水分子的球棍模型: |
C.F-离子的结构示意图: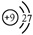 |
D.二氧化碳的电子式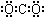 |