某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图2-26所示。该实验的主要操作步骤如下: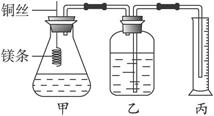
图2-26
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用_________量取10.00 mL 1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为_________;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全,记录_____________________________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应___________________________________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并完成下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:_______________________________。
(2)本实验中应选用______________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm=_________________。
(4)上述速率不等的原因是_______________________________________________________,
铜丝不与酸接触的原因是_______________________________________________________。
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,进行了以下实验。
(1)检验矿物样品中是否有Fe3+
实验用品:锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
实验步骤: ①取样:将样品用锤子敲碎,再在研钵中研细备用。
②溶解:将样品粉末倒入烧杯,加入___________,用玻璃棒充分搅拌。
③___________(填操作名称)。
④检验:取少许溶液,加入___________。实验现象:____________。
实验结论:矿物样品中含有Fe3+。
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)__________,反应的离子方程式是 ____________。
②同学们在新制得的亚铁盐溶液中加入适量的氢氧化钠溶液,制出的氢氧化亚铁呈__________色。为使试管中的氢氧化亚铁保存的时间更长,请在图中装置中加入什么物质_________。
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.l mo1·L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
请回答:
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)。乙方案中,说明HA是弱电解质的现象是
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中,难以实现之处是配制100mLpH=l的HA溶液;而不妥之处是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。
请回答:
(1) 生成的黑色(单质)物质是________(填化学式)。
(2) 这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是________(填名称),实验室经常用________溶液进行吸收,写出生成这种气体的化学方程式分别为:_______________________________
(3) 据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有_______________(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4) 将实验(2)产生的刺激性气味气体通入品红溶液,可以看到品红溶液________,加热后________。
(5) 能否用澄清石灰水鉴别这两种气体?____________(填“能”或“不能”)若不能填写两种能鉴别的试剂是________________________。
如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶中所装试剂为:B(碘化钾淀粉溶液)、C(紫色石蕊试液)、D(FeCl2溶液)、E(水)。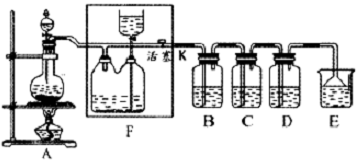
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为________________。
(2)F装置的作用为_____________;F装置瓶内宜加入的液体是________________。
(3)实验开始后B中的现象是_______________,C中的现象是________________。
(4)写出D中反应的化学方程式:__________________________________________。
(5)用量筒量取20 mL E中溶液,倒入已检漏的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是_____________(填“上层液”或“下层液”),再装入烧杯中,能使有色布条褪色的是_____________(填“上层液”或“下层液”)。
三氯化磷( )和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质。PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料。
I.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3。实验室制取PCl3的装置示意图和有关数据如下:
实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热。
(1)干燥管中碱石灰的作用是_______________。
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是____________________(己知亚磷酸H3PO3是二元弱酸:H3PO3 H++ H2PO3-,H2PO3-
H++ H2PO3-,H2PO3- H++HPO32-)。
H++HPO32-)。
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用____________方法除去PC13中的POCl3制备纯净的PCl3。
A.萃取B.过滤C.蒸馏D.蒸发结晶
II.氯化水解法生产POC13
主要反应是:PC13+C12+H2O=POC13+2HCl,流程如下:
(1)若将0.01mol POCl3加到水中水解,再与含2.4gNaOH的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是_____________[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(2)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量NaOH 溶液,再加稀硝酸至酸性。
B.向锥形瓶中加入0.1000 mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL。
己知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_____________(填字母序号),滴定终点的现象为_________________。
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确。如无此操作,所测Cl元素含量将会______________(填“偏大”、“偏小”或“不变”)。
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为______________。