用18 mol/L 浓硫酸配制100 mL 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.定容时俯视刻度线________________
(14分)铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:
已知:部分物质沉淀的pH如下表: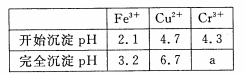
CaSO4的溶解度曲线如图: 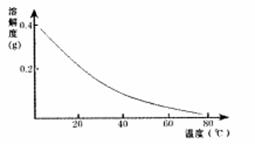
请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊液加热至80 ℃ 趁热过滤,所得滤渣Ⅱ的成分为。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1 l时,可以认为离子沉淀完全。第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为。(已知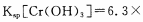
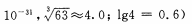
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学方程式
(15分)苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加人2.7 mL甲苯、100 mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加人8.5 g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。[来
二、分离提纯
在反应混合物中加人一定量草酸(H2C204)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取mg产品,配成100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)装置a的名称是____,其作用为_________
(2)甲苯被高锰酸钾氧化的原理为: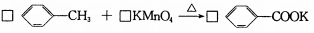

请完成并配平该化学方程式。
(3)分离提纯过程中加人的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加人草酸的作用是,请用离子方程式表示反应原理
(4)产品减压过滤时用冷水洗涤的原因是
(5)选用下列操作,可以将粗产品进一步提纯。(选填字母)
| A.溶于水后过滤 | B.溶于乙醇后蒸馏 |
| C.用甲苯萃取后分液 | D.升华 |
(6)测定纯度步骤中,滴定终点溶液的颜色变化是____。若m="1.200" g,滴定时用去0.1200 mol· L-1标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。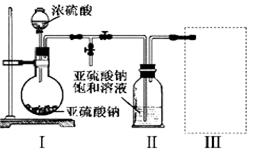
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3 + SO2 = Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号)。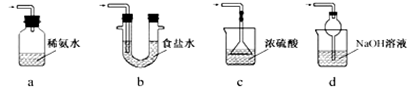
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4·5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
①红褐色滤渣的主要成分是__________;
②写出浸出过程中生成硝酸铜的化学方程式;
③操作I的温度应该控制在________左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液_______、______、洗涤、干燥。
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验。5min后可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是___________________。
某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹。此操作的目的是。
(3)实验过程装置B中没有明显变化。实验结束取下装置B,从中分别取少量溶液于两支洁净试管中。向第1支试管中滴加适量氨水出现白色沉淀(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是 。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有性。
(5)装置D的作用是。
(6)实验后,测定装置D中溶液呈碱性。溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种假设成立。可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
| 1 |
取少量溶液于试管,滴入几滴酚酞 |
溶液变红 |
| 2 |
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样。并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验。请计算该空气中SO2的体积分数(用含V的代数式表示)。