下列混合溶液中,各离子浓度的大小顺序正确的是()
A.10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
| B.10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C.10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| D.10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO2 | D.降低体系温度 |
已知:4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
A. v(NH3)=v(O2) v(NH3)=v(O2) |
B. v(O2)=v(H2O) v(O2)=v(H2O) |
C.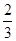 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D. v(O2)=v(NO) v(O2)=v(NO) |
一定条件下反应N2(g)+3H2(g) 2NH3(g)在10 L的密闭容器中进行,测得
2NH3(g)在10 L的密闭容器中进行,测得
2 min内,N2的物质的量由20 mol减小到8 mol,则2 min内N2的反应速率为( )
| A.1.2 mol·L-1·min-1 | B.1 mol·L-1·min-1 |
| C.0.6 mol·L-1·min-1 | D.0.4 mol·L-1·min-1 |
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
下列叙述正确的是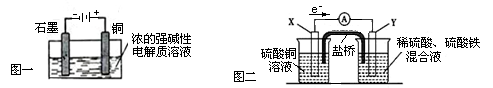
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |