实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净的氮气。反应方程式为
NaNO2+NH4Cl====NaCl+N2↑+2H2O(正反应放热)
如下图所示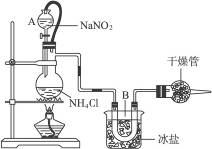
(1)装置中,A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是______________(填写编号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液顺利滴下
(2)B部分的作用是_______________________。
a.冷疑 b.冷却氮气 c.缓冲氮气流
(3)加药品前必须进行的一个操作步骤是____________;加热片刻后即应移去酒精灯以防止反应物冲出,其原因是____________________________。
(4)收集N2前,必须进行的步骤是(用文字说明)__________________;收集N2最适宜的方法是(填写编号)______________。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
下图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程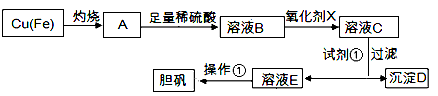
已知:
| 溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH |
≥3.7 |
≥6.4 |
≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是________(填字母)。
A.NaClOB.H2O2C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(3)操作①的名称是________。
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是________。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是________________(用离子方程式表示)。
某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体。
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收。
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:_________________________。
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:_________________________;
假设三:无色气体是SO2与H2的混合气体。
【实验验证】请你设计实验验证上述假设三,完成下表中内容。小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选。
| 实验方案与步骤 |
实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; |
若_____________________, 则无色气体中有SO2。 |
| 2.________________________________________________________________________________________________________________ |
若_______________________,则无色气体中有H2。 结合以上实验可知假设三成立。 |
草酸(H2C2O4)是生物体的一种代谢产物。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。已知草酸晶体(H2C2O4•2H2O)无色,易溶于水,熔点为101℃,受热脱水、升华,170℃以上分解。试回答下列问题: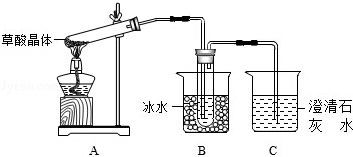
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置中,依次连接的合理顺序为:
A→B→()→D→G→()→D→I
装置H反应管中盛有的物质是__________________(写化学式)。
②能证明草酸晶体分解产物中有CO的现象是__________,__________,第二个D装置中澄清石灰水变浑浊。
某实验小组用下列装置进行乙醇催化氧化的实验.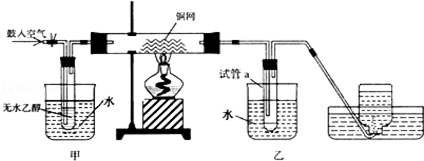
(1)实验中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式: .
不断鼓入空气,熄灭酒精灯,反应仍能继续,说明乙醇的氧化应是 反应.
(2)甲和乙两个水浴作用不相同.甲的作用是 ;乙的作用是 .
(3)反应进行一段时后,试管a中能收集到不同的物质,它们是 .集气瓶中收集到的气体的主要成分是 .
(4)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还有 .
要除去该物质,可先在混合液中加入 (填写字母).
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填实验操作名称)即可除去.
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求填写下列空格:
(I)如上图1所示,试管中装乙醇,(图示不一定准确)则反应现象为 ;
(II)如上图2所示,把加热的铜丝插入到装有乙醇的试管中,闻到有刺激性气味,该反应中产生的有机物为 ;(填结构简式);
(III)为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图3所示装置来进行实验验证。
①A中所盛试剂为___ ____。
②C中实验现象为 ,由实验可知这三种酸的酸性大小为 。
③该装置中存在不妥之处,请提出改正措施 。