如右图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2、HCl和O2。供选用的试剂有:
| A.浓H2SO4 | B.浓盐酸 | C.食盐 | D.二氧化锰 E.KMnO4F.H2O2 |
(1)若要快速制备Cl2应选择______________________________________________;
(2)若要快速制备少量HCl,应选择________________________________________;
(3)若要快速制备少量O2,应选择__________________________________________。
实验桌上有六瓶试剂,只知其可能为醋酸、盐酸、硫酸、氢氧化钾、氢氧化钙以及氨水。该同学取出其中两瓶,进行简易分析实验以辨识二者成分。
实验记录以下: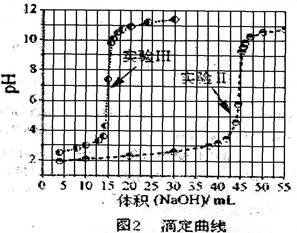 实验I从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
实验I从第一瓶溶液中取出25.00 mL,以标准NaOH溶液滴定,滴定结果列于表1中。
| 体积(NaOH)/mL |
pH |
||
| 5.0 |
2.2 |
||
| 10.0 |
2.4 |
||
20.0 |
3.0 |
||
| 24.0 |
3.8 |
||
| 24.8 |
4.5 |
||
| 25.0 |
7.0 |
||
| 25.2 |
9.5 |
||
| 26.0 |
10.0 |
||
| 30.0 |
10.7 |
实验Ⅱ从第一瓶溶液中取25.00 mL后,加入10.00 mL、0.01000 mol/L 的硫酸,再以同一标准NaOH溶液滴定,滴定结果绘于图2中。
实验Ⅲ从第一瓶与第二瓶溶液中分别取出25.00 mL与10.00 mL,相互混合之后,再以标NaOH溶液滴定。滴定结果也绘于图2中。
实验IV完成实验III后,再加入数滴BaCl2,溶液并无沉淀出现,但若改加草酸钠,则溶液出现白色沉淀。
(1)进行实验I时,若用酚酞作指示剂,判断达滴定终点对的依据是:_____________________。
(2)计算标准NaOH溶液的浓度______________mol/L。
(3)第二瓶溶液成分及其物质的量浓度_______________________、_______________mol/L。
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:

试回答下列问题
(1)操作①搅拌的目的是:_______________________。
(2)操作③名称是:______________________________。
(3)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为;_________。配制该质量浓度的溶液所需的玻璃仪器有:__________________。
(4)反应器中,NaOH、NaClO及Fe(NO3)3反应的化学方程式:
_____________________________________________________
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: ▲ ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。
| 实验操作 |
实验现象或 预期实验现象 |
现象解释 (用离子方程式表示) |
|
| 猜想② |
▲ |
溶液pH=8 |
— |
| 向pH=2的硫酸中滴加Na2S2O3溶液 |
▲ |
S2O32—+2H+=S↓+SO2↑+H2O |
|
| 猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
⑴甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 ▲ 。
⑵请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 ▲ 。
重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下: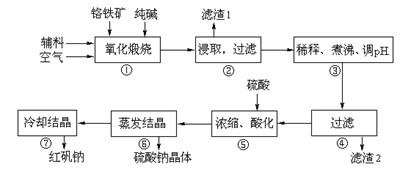
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
⑴ “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ▲。两个副反应均为吸热反应,但在高温下均能自发进行,其原因是 ▲。
⑵ “③”中调节pH至4.7,目的是 ▲。
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ▲。
⑷ “⑦”中采用冷却结晶的方法析出红矾钠,依据是 ▲。
某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设::。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
| A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化 |
| B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣 |
| C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却, 再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系 |
| D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色 |
沉淀析出。
你认为合理的方案是(填字母)。
(2)乙小组针对甲小组的假设,另设计如如下图装置进行验证。
若按乙组装置定性检验上述红色沉淀成分,可根据现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量(填序号)。
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有
(请写出两点)。