分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
| 金属片 |
电子流动方向 |
电压表读数 |
| A |
Cu←A |
+0.67 |
| B |
Cu→B |
-0.71 |
| C |
Cu←C |
+1.35 |
| D |
Cu←D |
+0.30 |
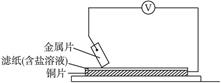
已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
⑴取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
⑵继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
⑶取少量(2)中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有,一定不含有,可能含有。
⑷检验可能含有的物质是否存在的实验方法。
同温同压下,同体积的氨气和硫化氢气体的质量比是,密度比是;同质量的氨气和硫化氢气体的体积比是,两者所含氢原子个数比是。
有以下几种物质①食盐晶体②液态氯化氢③水银④蔗糖⑤熔融的KBr
⑥KNO3溶液⑦SO3,填空回答:(填序号)
⑴以上物质中属于电解质且能导电的是;
⑵以上物质中属于非电解质的是。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1) B的氯化物的熔点比其同周期相邻元素氯化物的熔点________(填高或低)。
(2)A、B、C、D的第一电离能由小到大的顺序为 __ _______________。(用元素符号表示)
_______________。(用元素符号表示)
(3)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为____________;(每个球均表示1个原子)
(4)F的价电子轨道表示式是______________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______________________。
氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g)  H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。