配制下列溶液的操作使溶液浓度偏高的是()
| A.等体积18 mol·L-1浓H2SO4和蒸馏水混合配制9 mol·L-1 H2SO4 |
| B.配制500 mL 6 mol·L-1盐酸,容量瓶未干燥就配制溶液 |
| C.配制1 mol·L-1 NaOH溶液,已定容后,再正倒摇匀,竖直后发现液面稍低于刻度线 |
| D.配制好的0.2 mol·L-1 NaCl溶液从容量瓶转移到刚用蒸馏水洗净的清洁玻璃塞细口瓶中 |
下列事实于氢键有关的是
| A.水加热到很高的温度都难以分解 | B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的增大而升高 | |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
最近科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合成为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
| A.该物质的化学式为CO4 | B.晶体的溶沸点高,硬度大 |
| C.晶体中C原子数与C-O化学键之比1:4 | D.晶体的空间最小环共由12个原子构成 |
氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的粒子间的作用力与氮化硅所克服的粒子间的作用力都相同的是
| A.石膏和金刚石 | B.晶体硅和水晶 |
| C.冰和干冰 | D.铝和蒽 |
下列物质的熔、沸点高低顺序正确的是
| A.金刚石>晶体硅>二氧化硅>碳化硅 | B.CI4>CBr4>CCl4>CH4 |
| C.MgO>H2O>O2>NH3 | D.金刚石>生铁>纯铁>钠 |
已知:2CO(g)+O2(g)=2CO2(g)ΔH="-566" kJ/mol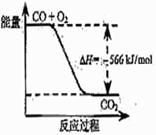

 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+ 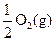 ΔH="-226" kJ/mol
ΔH="-226" kJ/mol 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023