200 mL 0.2 mol·L-1和100 mL 0.5 mol·L-1的两种盐酸混合,设得到300 mL盐酸,其物质的量浓度是________。若所得盐酸的密度为1.004 g·cm-3,则其溶质的质量分数是____。
(15分)水是生命之源,广西重金属镉污染事件是2012年1月15日发现的。水污染事件再次提醒人们保护水资源的必要性和紧迫性。工业废水中常含有一定量的Cr2O和CrO,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:
2CrO(黄色)+2H+ Cr2O(橙色)+H2O
Cr2O(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。(填序号)
A.Cr2O和CrO的浓度相同
B.2v(Cr2O)=v(CrO)
C.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法。
该法用 Fe 做电极电解含Cr2O的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为____(用电极反应式解释)。
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有________。(用化学式表示)
(7)溶液中发生的总反应为(用离子方程式表示)。
(15分)中学化学常见部分元素原子结构及性质如下表所示:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② |
B |
B原子K、L、M层电子数之比是1:4:1 |
| ③ |
C |
C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ |
D |
D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ |
F |
F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)①A元素在周期表中的位置为___________________。
②检验某溶液中含A的低价离子而不含其高价离子的方法是
。
(2)B与C形成的化合物的电子式为。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的实验方法是_____________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则N的结构式为________。
(4)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)______________________ ___________________________。
(5)(在25°C、101 kPa下,已知D的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是
________________________________________________________________。
化合物A、B均是分子式为C8H8O3的无色液体,均难溶于水。从A、B开始,可发生图示的一系列反应(反应中的无机物已全部略去),E的苯环上的一氯代物只有两种。H、G均可发生银镜反应。已知: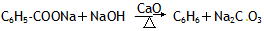

(1) 写出结构简式:A_________________________、B__________________________。
(2) H和G中含有相同的官能团,该官能团的名称_______________________________。
(3) 写出C→C4H4O4反应的化学方程式:
_________________________________________________________________________
(4) D的溶液与过量浓溴水反应的化学方程式为:
________________________________________________________________________
(5) 化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种的所有同分异
构体的结构简式:
______________________________________,________________________________
(6) F与氧气构成燃料电池的两极,用NaOH溶液做电解质溶液。请写出负极的电极方程式:______________________________________________
A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相差4。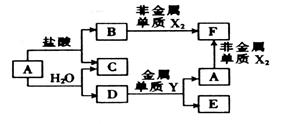
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型:;D的化学式为;元素X、Y的原子半径大小顺序是(用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为。
(3)反应A+H2O→C+D的化学方程式为。
(4)F能促进H2O的电离,其原因是(用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH=。
A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似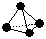 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O _________________________。
_________________________。