在关于物质的溶解性的判断时有一个很好的理论:相似相溶原理,也就是说极性分子形成的物质易溶于极性分子所形成的溶剂,非极性分子形成的物质易溶于非极性分子所形成的溶剂。例如Br2、I2易溶于有机溶剂却难于水,请根据这个理论推测一下HBr在水和CCl4中的溶解情况并说明理由:_________________________________________________________。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g )△H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g )△H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程: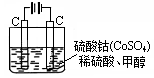
①写出阳极电极反应式。
②写出除去甲醇的离子方程式。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极反应式
负极。
有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置。
⑵元素A的非金属(填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子(填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式。
⑸氧化铜与D的单质在高温下发生化学反应的方程式
,若得到1mol氧化产物,则该反应转移电子mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因。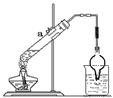
选择下列物质分离和检验方法,将其序号填在横线上。
| A.萃取 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体。
0.5mol H2SO4的质量是g,含个氧原子,能和molNaOH完全反应,该硫酸所含氢元素的质量与mol H3PO4或标准状况下L HCl中所含氢元素的质量相同。
成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入 ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有
(写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做 。
②写出化合物A与CH3COOH反应的化学方程式为 ,该反应的类型为 。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g和 3.52g。则分子中C、H原子的个数比 。苹果酸的分子式是 。