实验室需用浓度为18.4 mol•L-1 浓硫酸配制3.68 mol•L-1 的稀硫酸250mL。填写下列空格。
(1)实验步骤(请补全实验操作过程):
①用量筒取浓硫酸__________mL。
②将浓硫酸慢慢注入盛有少量蒸馏水的小烧杯中,并不断搅拌。
③立刻将稀释后硫酸溶液沿玻璃棒注入容量瓶中。
④用少许蒸馏水洗涤小烧杯,将洗涤液沿玻璃棒注入容量瓶并重复_______次。
⑤继续向容量瓶内小心加蒸馏水,直至距离刻度线__________处。
⑥改用胶头滴管加蒸馏水,使液体的凹液面与刻度线相切。
⑦将容量瓶盖紧摇匀,并将所配溶液装入试剂瓶贴好标签。
上述操作有无不当之处,请指出,并加以改正:__________。
(2)实验中除用量筒、烧杯、胶头滴管、玻璃棒外,还用到的玻璃仪器有_______;
(3)若出现如下情况,对所配溶液浓度的影响是(选填“偏高”、“偏低”或“无影响”);
a.没有进行操作步骤④_______;b.开始时容量瓶没有干燥__________;
(4)其实验过程中出现如下情况应如何处理?
a.定容时加蒸馏水不慎超过了刻度线____________;
b.向容量瓶中转移溶液时(步骤②)不慎有液滴掉在容量瓶外面___________。
化学计量在化学中占有重要地位,请回答下列问题:
(1)现有mg某气体,它由双原子分子构成,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为___ _____;
_____;
②该气体所含原子总数为个;
③该气体在标准状况下的体积为__________。
(2)与标准状况下V LCO2所含氧原子数目相同的水的质量是_______(用分式表示)。
(3)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(4)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42 -,测得Na+、Mg2
-,测得Na+、Mg2 +和Cl-
+和Cl-
的物质的量浓度依次为:0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则c(SO42-)="___________" 。
现有以下5种物质:H2O、SiO2、CaO、Na2O2、Al2O3。
(1)按照不同的分类标准,它们中有一种物质与其它物质有明显的不同,请找出这种物质并写出依据(试写出任意一种合理的分类方法):
。
(2)上述物质中有些可以两两反应,试写出一个属于氧化还原反应的离子反应方程式__________ ______________________________________________________________。
______________________________________________________________。
图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白: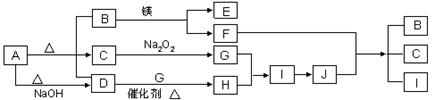
(1)写出下列反应的化学方程式:
D+G→ H,
F+J → B + C + I。
(2)写出A+NaOH→D的离子方程式。
(3)J的浓溶液久置后显黄色,其原因用化学方程式表示为_________________________。
(8分)W固体受热分解为三种产物,其产物之间又能发生反应的转化关系如下图所示,试推断并回答填空:
(1)写出下列物质的化学式:A________________ E____________
(2)写出W受热分解反应的化学方程式:_______________________________________
(3)写出D + A → W + E + H2O反应的离子方程式:
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式。
(3)Z的最高价氧化物对应水化物的电离方程式 。
。
(4)元素T与氟元素相比,非金属性较强的是(写元素符号),下列能证明该事实的是
a.常温下氟气的颜色比T单质的颜色深 b.氟 气与T的氢化物剧烈反应,产生T的单质
气与T的氢化物剧烈反应,产生T的单质
c.氟与T 形成的化合物中T元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
形成的化合物中T元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目