氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。
请完成下列问题:
(1)Na3N是由 键形成的化合物。
(2)Na3N与盐酸反应生成 种盐。
(3)Na3N与水的反应属于 反应
Ⅰ.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,请回答: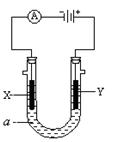
(1)X极上的电极反应式:。
在X极附近观察到的现象是。
(2)Y电极上的电极反应式为,检验该电极反应产物的方法是。
Ⅱ.三峡大坝使万里长江变成黄金水道,但三峡船闸的防腐蚀是现实而又紧迫的任务,请你分析:
(1)船闸(钢体)主要发生的是腐蚀,并请写出腐蚀的电极反应式:
负极:;
正极:。
(2)请你对三峡船闸的防腐蚀提出一项合理化建议:
。
在一定体积的密闭容器中进行如下反应:
CO2(g)+H2(g) CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O)d.c(CO2)=c(CO)
(4)若向容器中投入各物质2mol,加热到800℃使反应进行,则此时反应的生成物是。
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是_______________。
(2)该反应中,发生还原反应的过程是→。
(3)该反应中氧化剂与还原剂物质的量之比为。
(4)如反应转移了0. 3mol电子,则产生的气体在标准状况下体积为。
铁及铁的化合物应用广泛,如 FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出 FeCl3溶液腐蚀印刷电路铜板的离子方程式。。
(2)若将(1)中的反应设计成原电池,请补充右边原电池的装置图,在括号内填上正、负极的材料、电解质溶液,并写出电极反应式。正极反应
负极反应
(3)腐蚀铜 板后的混合溶液中,若 Cu2+、Fe3+和 Fe2+的浓度均为 0.10mol.L-1,请参照下表给出的数据和药品,简述除去 CuCl2溶液中 Fe3+和Fe2+的实验步骤:
板后的混合溶液中,若 Cu2+、Fe3+和 Fe2+的浓度均为 0.10mol.L-1,请参照下表给出的数据和药品,简述除去 CuCl2溶液中 Fe3+和Fe2+的实验步骤:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1. 9 9 |
3.2 |
| Fe2+ |
7.0 |
9.0 |
| Cu2+ |
4.7 |
6.7 |
 提供的药品:Cl2浓H2SO4 NaCl-溶液 CuO Cu 提供的药品:Cl2浓H2SO4 NaCl-溶液 CuO Cu |
实验步骤:
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的 H2还原 CuO粉末来测定 Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲中发生反应的离子方程式
(2)为完成上述实验,正确的连接顺序为A连;B连 (填写连接的字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为。
(4)若检验氯气的氧化性,则乙装置的 a瓶中溶液可以是,对应的现象为 。
(5)丙装置的 c瓶中盛放的试剂为,作用是。
(6)测定 Cu的相对原子质量:精确测量硬质玻璃管的质量为Ag,放入CuO后,精确测量硬质玻璃管和 CuO的总质量为Bg,实验完毕后精确测量硬质玻璃管和 Cu粉的总质量为cg。Cu的相对原子质量表达式(用 a、b、c表示)为。(已知氧的相对原子质量为 16)