如图3-28表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
图3-28
(1)代表金刚石的是(填编号字母,下同) __________,其中每个碳原子与__________个碳原子最接近且距离相等。金刚石属于__________晶体。
(2)代表石墨的是__________,其中每个正六边形占有的碳原子数平均为__________个。
(3)代表NaCl的是__________,每个Na+周围与它最接近且距离相等的Na+有__________个。
(4)代表CsCl的是__________,它属于__________晶体,每个Cs+与__________个Cl-紧邻。
(5)代表干冰的是__________,它属于__________晶体,每个CO2分子与__________个CO2分子紧邻。
(6)若说“离子晶体中只有离子键,分子晶体中没有化学键”是否正确?简答理由。
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是__________;其中在熔融或液态时能导电的电解质是__________,液态不导电但为电解质的是__________,在水溶液中能导电的非电解质是__________。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: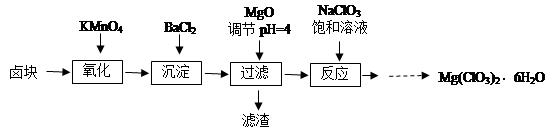
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。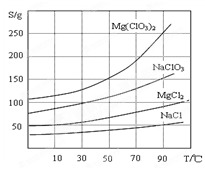
(1)过滤所需要的主要玻璃仪器有。
(2)加入BaCl2的目的是,加MgO后过滤所得滤渣的主要成分为。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:;
②产品中Mg(ClO3)2·6H2O的质量分数为。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL容量瓶中定容成250mL烧碱溶液; |
| B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)

 D
D  。
。
(2)操作E中的锥形瓶下垫一张白纸的作用是。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是。
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):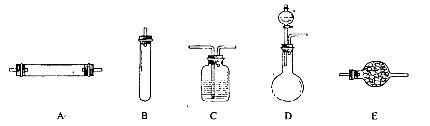
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
下图为探讨苯和溴的反应改进的实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一个小孔,并塞好石棉绒,实验时先加少量铁粉于石棉绒上。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内发生反应,写出A中所发生反应的化学方程式、;
(2)反应开始后观察D和E两试管,看到的现象为、。
(3)B中的NaOH溶液作用是
(4)在上述整套装置中,具有防倒吸的仪器除F外还有(填字母)。
(1)某学生欲用11.9 mol·L-1的浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取________mL浓盐酸进行配制。(保留小数点后1位)
(2)容量瓶是配制溶液的必需仪器。下列关于容量瓶及其使用方法的叙述,错误的是
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度 、容量 、刻度线
a.①③ b.①④c.③⑤d.⑤⑥
(3)① 该同学用配制的0.400 mol·L-1的盐酸,中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
② 假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
a.浓盐酸挥发,浓度不足
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.加水时超过刻度线,用胶头滴管吸出